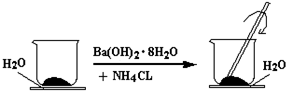
题目内容
19. 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料,(1)已知一定条件下88gCO2和足量氢气完全反应三可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量.请回答:
①该反应的热化学方程式:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol.
②若生成3mol甲醇放出的热量为147KJ.
③利用该反应能否设计一个原电池(写能或不能)能,若能请在方框内画出,并写出正负极的电极的电极反应式(括号内注明反应类型)正极电极反应:CO2+6H++6e-=CH3OH+H2O(还原反应)
 负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空
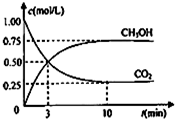
负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)=0.225mol•L-1•min-1 .
②下列措施中能使v(CO2)增大的是AD.
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.升高温度
③能够说明该反应已达到平衡的是AC.
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度不再变化
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH.
E.有2个C=O键断裂的同时,有3个H-H键断裂.
分析 (1)①根据n=$\frac{m}{M}$计算88gCO2和氢气化合生成甲醇和水放出的热量,结合热化学方程式书写方法标注物质聚集状态和反应焓变写出;
②反应热与化学计量数成正比,根据热化学方程式计算;
③反应焓变△H<0,△S<0,低温下△H-T△S<0反应自发进行,此反应为氧化还原反应可以设计为原电池;
(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;
①依据化学平衡三段式列式利用V=$\frac{△c}{△t}$计算;
②依据升温,增加浓度,加压,加催化剂等可以加快反应速率判断;
③可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析解答.
解答 解:(1)①88gCO2的物质的量为n=$\frac{m}{M}$=$\frac{88g}{44g/mol}$=2mol,放出98kJ的热量,每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol,
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol;
②每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,若生成3mol甲醇放出的热量为49kJ×3=147KJ,
故答案为:147KJ;
③CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol,反应焓变△H<0,△S<0,低温下△H-T△S<0反应自发进行,此反应为氧化还原反应可以设计为原电池,酸性溶液中,二氧化碳在正极发生还原反应,电极反应为CO2+6e-+6H+=CH3OH+2H+,氢气失电子在负极发生氧化反应,电极反应为:3H2-6e-=6H+,装置图为:
正极电极反应:CO2+6H++6e-=CH3OH+H2O (还原反应) 负极电极反应为:3H2-6e-=6H+(氧化反应)
负极电极反应为:3H2-6e-=6H+(氧化反应)
故答案为:能;正极电极反应:CO2+6H++6e-=CH3OH+H2O (还原反应) 负极电极反应为:3H2-6e-=6H+(氧化反应)
负极电极反应为:3H2-6e-=6H+(氧化反应)
(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则①依据化学平衡列式计算为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
H2的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol•L-1•min-1 ;
故答案为:0.225mol•L-1•min-1 ;
②A.加入催化剂,v (CO2)增大,故A正确;
B.充入He(g),使体系压强增大,但反应物浓度不变,所以v (CO2)不变,故B错误;
C.将H2O(g)从体系中分离,则生成物浓度减小,则浓度减小,故C错误;
D.升高温度,v (CO2)增大,故D正确;
故选:AD;
③A.反应前后气体的体积不等,所以压强一直在变,则当压强不变时能说明达到平衡,故A正确;
B.反应前后质量不变,体积也不变,所以密度一直不变,则混合气体的密度不再变化不能说明达到平衡,故B错误;
C.CO2、H2和CH3OH的浓度不再变化,说明达到平衡,故C正确;
D.单位时间内消耗3molH2的同时生成1molCH3OH,都是指正反应方向,不能说明达到平衡,故D错误;
E.CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol,CO2结构简式为O=C=O,1个分子有2个C=O键,当2个C=O键断裂的同时,必有3个H-H键断裂.与是否已达到平衡无关,故E错误;
故选AC.
点评 本题考查了热化学方程式的书写原则,化学反应速率、平衡状态的判断以及化学平衡的计算的应用,图象分析是关键,综合性较大,难度中等.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| A. | 向无水乙醇中加入浓H2SO4,加热至170℃,将产生的气体通入酸性KMnO4溶液中紫红色褪去,使溶液褪色的气体一定是乙烯 | |
| B. | 苯酚钠溶液中通入少量二氧化碳得到苯酚和碳酸钠溶液 | |
| C. | 正丁烷的所有碳原子都在同一条直线上 | |
| D. | 实验室可用电石与饱和食盐水反应制取乙炔气体 |
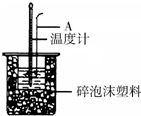 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和.
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(5)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?不断读取温度数据,并记录,直到出现下降,取最大值.
| A. | CO2、H2O2 | B. | C2H4、CH4 | C. | C60、C2H4 | D. | NH3、HCl |
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
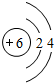
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于)
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
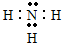
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O=H++Cl-+HClO
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)举一例说明C和I金属性的强弱Na与冷水剧烈反应,Mg与沸水缓慢反应
(7)用电子式表示由I和H组成的化合物的形成过程
 .
. | A. | 原子序数A>B | B. | 电子总数A->B2+ | C. | 离子半径A->B2+ | D. | 原子半径A>B |
| A. | 异戊二烯(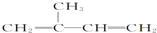 )与等物质的量的H2发生加成反应 )与等物质的量的H2发生加成反应 | |
| B. | 2-甲基-2-氯丁烷与NaOH乙醇溶液共热发生消去反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
 酚类;
酚类; 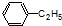 烃(或芳香烃);
烃(或芳香烃);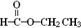 酯(或酯类);
酯(或酯类); 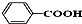 酸类(或芳香酸).
酸类(或芳香酸).