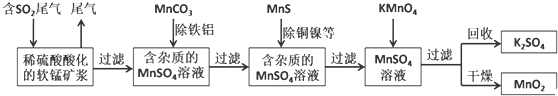
题目内容
工业上以铬铁矿(主要成分为FeO?Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O),其主要反应为:下列说法正确的是( )
(1)4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O.
(1)4FeO?Cr2O3+8Na2CO3+7O2
| ||
(2)2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O.
| A、反应(1)和(2)均为氧化还原反应 |
| B、反应(1)的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C、高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D、反应(1)中每生成1molNa2CrO4时电子转移3mol |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A、化学反应中有元素化合价变化的反应是氧化还原反应,没有化合价变化的化学反应不是氧化还原反应;
B、得电子化合价降低的物质是氧化剂,失电子化合价升高的物质是还原剂;
C、同一化学反应中氧化剂的氧化性大于氧化产物的氧化性;
D、反应只有O元素的化合价降低,由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,由方程式可知计算Na2CrO4与转移电子数,再换算为生成1mol的Na2Cr2O7时转移电子数.
B、得电子化合价降低的物质是氧化剂,失电子化合价升高的物质是还原剂;
C、同一化学反应中氧化剂的氧化性大于氧化产物的氧化性;
D、反应只有O元素的化合价降低,由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,由方程式可知计算Na2CrO4与转移电子数,再换算为生成1mol的Na2Cr2O7时转移电子数.
解答:
解:A、4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2中有元素化合价的变化,所以是氧化还原反应,而2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O中没有元素化合价的变化,所以不是氧化还原反应,故A错误;
B、4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2,氧气中氧元素得电子化合价降低,所以氧化剂是氧气,铁元素和铬元素失电子化合价升高,所以还原剂是FeO?Cr2O3,故B正确;
C、4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2中,氧化剂是氧气,还原剂是FeO?Cr2O3,氧化产物是Na2CrO4,所以氧气的氧化性大于Na2CrO4和Fe2O3,故C错误;
D、由方程式4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2转移电子可知,生成1molNa2CrO4时,参加反应的O2的物质的量为
mol,反应中O元素由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,转移电子的物质的量为
mol×4=3.5mol,所以反应(1)中每生成1molNa2CrO4时电子转移3.5mol,故D错误;
故选B.
| ||
B、4FeO?Cr2O3+8Na2CO3+7O2
| ||
C、4FeO?Cr2O3+8Na2CO3+7O2
| ||
D、由方程式4FeO?Cr2O3+8Na2CO3+7O2
| ||
| 7 |
| 8 |
| 7 |
| 8 |
故选B.
点评:本题考查了氧化剂和还原剂的判断、氧化还原反应的判断等知识点,根据元素化合价的变化判断氧化还原反应、氧化剂和还原剂即可分析解答本题,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 常温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1某二元弱酸H2R溶液所得滴定曲线如图(混合溶液总体积可看成混合前两种溶液体积之和).下列关系正确的是( )
常温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1某二元弱酸H2R溶液所得滴定曲线如图(混合溶液总体积可看成混合前两种溶液体积之和).下列关系正确的是( )| A、点②所示溶液中:c(K+)+c(H+)=c(HR-)+c(R2-)+c(OH-) |
| B、点③所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) |
| C、点④所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.04 mol/L |
| D、点⑤所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) |
水溶液中能大量共存的一组离子是( )
| A、K+、Ca2+、Cl-、NO3- |
| B、H+、Fe2+、SO42-、ClO- |
| C、Na+、Fe3+、Cl-、CO32- |
| D、K+、NH4+、OH-、SO42- |
化学与生产、生活密切相关.下列叙述错误的是( )
| A、光导纤维和陶瓷都是硅酸盐产品 |
| B、晶体硅可用于制造芯片 |
| C、钢铁厂用热还原法冶炼铁 |
| D、焙制糕点的发酵粉主要成分之一是碳酸氢钠 |
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)=2H2O (l)△H=-285.8 kJ?mol-1 |
| B、2H2(g)+O2(g)=2H2O (l)△H=+571.6 kJ?mol-1 |
| C、2H2(g)+O2(g)=2H2O (g)△H=-571.6 kJ?mol-1 |
| D、H2(g)+1/2O2(g)=H2O (l)△H=-285.8 kJ?mol-1 |