题目内容
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)=2H2O (l)△H=-285.8 kJ?mol-1 |
| B、2H2(g)+O2(g)=2H2O (l)△H=+571.6 kJ?mol-1 |
| C、2H2(g)+O2(g)=2H2O (g)△H=-571.6 kJ?mol-1 |
| D、H2(g)+1/2O2(g)=H2O (l)△H=-285.8 kJ?mol-1 |
考点:热化学方程式
专题:
分析:A、根据4g氢气燃烧生成液态水,放出571.6kJ热量来分析;
B、根据4g氢气燃烧生成液态水,放出571.6kJ热量,放热时焓变值为负值来分析;
C、根据4g氢气燃烧生成液态水,放出571.6kJ热量,放热时焓变值为负值来分析;
D、根据2g氢气燃烧生成液态水,放出285.8kJ热量,放热时焓变值为负值来分析.
B、根据4g氢气燃烧生成液态水,放出571.6kJ热量,放热时焓变值为负值来分析;
C、根据4g氢气燃烧生成液态水,放出571.6kJ热量,放热时焓变值为负值来分析;
D、根据2g氢气燃烧生成液态水,放出285.8kJ热量,放热时焓变值为负值来分析.
解答:
解:A、因4g氢气燃烧生成液态水,放出热量571.6kJ,不是285.8kJ,故A错误;
B、因4g氢气燃烧生成液态水,放出热量571.6kJ,放热时焓变值为负值,故B错误;
C、因4g氢气燃烧生成液态水,不是气态水,放出热量571.6kJ,故C错误;
D、因2g氢气燃烧生成液态水,放出285.8kJ热量,放热时焓变值为负值,故D正确;
故选:D.
B、因4g氢气燃烧生成液态水,放出热量571.6kJ,放热时焓变值为负值,故B错误;
C、因4g氢气燃烧生成液态水,不是气态水,放出热量571.6kJ,故C错误;
D、因2g氢气燃烧生成液态水,放出285.8kJ热量,放热时焓变值为负值,故D正确;
故选:D.
点评:本题主要考查热化学方程式的书写方法及系数的含义,注意焓变的正负和物质的状态.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
工业上以铬铁矿(主要成分为FeO?Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O),其主要反应为:下列说法正确的是( )
(1)4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O.
(1)4FeO?Cr2O3+8Na2CO3+7O2
| ||
(2)2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O.
| A、反应(1)和(2)均为氧化还原反应 |
| B、反应(1)的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C、高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D、反应(1)中每生成1molNa2CrO4时电子转移3mol |
下列解释事实的方程式错误的是( )
| A、测得0.1 mol?L-1氨水的pH为11:NH3?H2O?NH4++OH- | ||||
| B、将Na块投入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | ||||
C、用CuCl2溶液做导电实验,灯泡发光:CuCl2
| ||||
D、将1 mol?L-1FeCl3溶液滴入沸水中,得到透明红褐色液体:FeCl3+3H2O
|
用惰性电极电解下列物质的水溶液,一段时间后(温度不变),再加入一定质量的另一种物质(括号内物质),溶液能恢复到与电解前的溶液完全一样的是( )
| A、CuCl2(CuO) |
| B、NaOH(Na2O) |
| C、NaCl(NaCl) |
| D、H2SO4(H2O) |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、在标准状况下,2.24 L HF含有的电子数为NA |
| B、7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA |
| C、常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
| D、电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |
下列描述中,不符合生产实际的是( )
| A、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、电解熔融的氧化铝制取金属铝,用镁作阳极 |
| D、在镀件上电镀锌,用锌作阳极 |


 当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示:
当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示: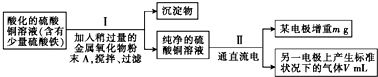
 某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=
某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=