题目内容
将12.4g钠和过氧化钠混合物完全溶于水中得100mL溶液,所收集的气体在一定条件下恰好完全反应,则所得溶液的物质的量浓度是多大?(写出计算过程)
考点:有关混合物反应的计算
专题:
分析:设出Na2O2、Na的物质的量分别为x mol、y mol,根据方程式2Na2O2+2H2O=4NaOH+O2↑、2Na+2H2O=2NaOH+H2↑表示出氧气、氢气的物质的量,再根据所收集的气体在一定条件下恰好完全反应可知:n(H2)=2n(O2),据此列式计算出钠和过氧化钠的物质的量,再根据质量守恒计算出氢氧化钠的物质的量,最后根据c=
计算出所得溶液的物质的量浓度.
| n |
| V |
解答:
解:设Na2O2、Na的物质的量分别为x mol、y mol,根据质量可得:①78x+23y=12.4;
所收集的气体在一定条件下恰好完全反应,说明反应生成气体物质的量满足:n(H2)=2n(O2),
根据方程式2Na2O2+2H2O=4NaOH+O2↑、2Na+2H2O=2NaOH+H2↑可知,n(H2)=
y=2n(O2)=2×
x,即:②x=
y,
根据①②联立解得:x=0.1、y=0.2,
反应后溶液中溶质为NaOH,根据Na元素质量守恒可知氢氧化钠的物质的量为:0.1mol×2+0.2mol=0.4mol,
所得溶液中氢氧化钠的物质的量浓度为:
=4mol/L,
答:所得溶液中氢氧化钠的物质的量浓度为4mol/L.
所收集的气体在一定条件下恰好完全反应,说明反应生成气体物质的量满足:n(H2)=2n(O2),
根据方程式2Na2O2+2H2O=4NaOH+O2↑、2Na+2H2O=2NaOH+H2↑可知,n(H2)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
根据①②联立解得:x=0.1、y=0.2,
反应后溶液中溶质为NaOH,根据Na元素质量守恒可知氢氧化钠的物质的量为:0.1mol×2+0.2mol=0.4mol,
所得溶液中氢氧化钠的物质的量浓度为:
| 0.4mol |
| 0.1L |
答:所得溶液中氢氧化钠的物质的量浓度为4mol/L.
点评:本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意质量守恒在化学计算中的应用,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
工业上以铬铁矿(主要成分为FeO?Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O),其主要反应为:下列说法正确的是( )
(1)4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O.
(1)4FeO?Cr2O3+8Na2CO3+7O2
| ||
(2)2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O.
| A、反应(1)和(2)均为氧化还原反应 |
| B、反应(1)的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C、高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D、反应(1)中每生成1molNa2CrO4时电子转移3mol |
下列描述中,不符合生产实际的是( )
| A、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、电解熔融的氧化铝制取金属铝,用镁作阳极 |
| D、在镀件上电镀锌,用锌作阳极 |
 A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )
A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )| A、A、B、C中一定有一种是氧元素的单质 |
| B、D、E中一定都含有A的元素 |
| C、单质B肯定是氧化剂 |
| D、若A是非金属,则B一定为金属 |
 当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示:
当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示: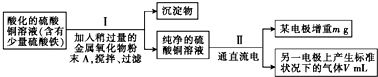
 某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=
某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=