题目内容
14.有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层(第三层)电子数比L层(第二层)少1个电子;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒都具有与氖原子相同的电子层结构.回答下列问题:(1)写出下列元素的名称:A铝、B氯、D钠
(2)画出A离子、C原子的结构示示意图:
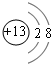 、
、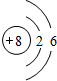 .
.
分析 A、B、C、D四种元素,A元素是地壳中含量最多的金属元素,故A为Al元素;B元素的原子其M层电子数比L层少1个电子,故M层电子数为8-1=7,故B为Cl元素;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒都具有与氖原子相同的电子层结构,故C原子核外电子数为10-2=8,则C为O元素,D元素原子核外电子数为10+1=11,故D为Na元素.
解答 解:(1)A、B、C、D四种元素,A元素是地壳中含量最多的金属元素,故A为Al元素;B元素的原子其M层电子数比L层少1个电子,故M层电子数为8-1=7,故B为Cl元素;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒都具有与氖原子相同的电子层结构,故C原子核外电子数为10-2=8,则C为O元素,D元素原子核外电子数为10+1=11,故D为Na元素,
故答案为:铝;氯;钠;
(2)A离子为Al3+,核外电子数为10,有2个电子层,最外层电子数为8,离子结构示意图为 ,
,
C为氧元素,原子核外电子数为8,原子结构示意图为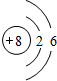 ,
,
故答案为: ;
;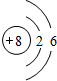 .
.
点评 本题考查结构与位置关系、原子结构示意图等,比较基础,推断元素是解题的关键,注意离子中质子、电子、电荷之间的关系.

练习册系列答案
相关题目
5.某原子的外围电子排布式为3d14S2,下列说法正确的是( )
| A. | 该元素位于元素周期表第三周期表ⅢB族 | |
| B. | 该元素位于s区 | |
| C. | 该元素为金属元素 | |
| D. | 该元素原子M能层共有8个电子 |
6.下列离子方程式中,书写正确的是( )
| A. | 稀硫酸和铁的反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 盐酸和碳酸钙反应:2H++CO32-=H2O+CO2↑ | |
| C. | 硫酸铜和氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | |
| D. | 往氯化铝溶液中滴加过量的氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O |
3.在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
| A. | 含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ |
4.下列各组离子在饱和氯水中能大量共存的是( )
| A. | Fe2+、Na+、Cl-、NO3- | B. | Na+、Al3+、SO42-、Cl- | ||
| C. | NH4+、K+、NO3-、S2- | D. | Na+、K+、HCO3-、SiO32- |
 .
. A、B、C、D、E、F六种元素的原子序数依次增大,A的最高价和最低价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道是4s电子数的4倍.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高价和最低价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道是4s电子数的4倍.请回答下列问题: