题目内容
4.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:①比较Na3N中两种微粒的半径r(Na+)<r(N3-)(填“>”“<”或“=”),
②Na3N与水反应属于非氧化还原反应(填“氧化还原”或“非氧化还原”);
③Na3N与盐酸反应生成两种盐的化学式为NH4Cl、NaCl;
④写出化合物Na3N的电子式:
 .
.
分析 ①电子层结构相同的离子,核电荷数越大离子半径越小;
②Na3N与水反应生成NaOH与氨气,元素化合价没有发生变化;
③Na3N与盐酸反应生成两种盐为氯化铵与氯化钠;
④Na3N属于离子化合物,由钠离子与氮离子构成.
解答 解:①电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径r(Na+)<r(N3-),
故答案为:<;
②Na3N与水反应生成NaOH与氨气,元素化合价没有发生变化,属于非氧化还原反应,
故答案为:非氧化还原;
③Na3N与盐酸反应生成两种盐为氯化铵与氯化钠,
故答案为:NH4Cl、NaCl;
④Na3N属于离子化合物,由钠离子与氮离子构成,电子式为: ,故答案为:
,故答案为: .
.
点评 本题考查微粒半径半径、氧化还原反应、电子式书写、信息获取与迁移运用等,注意对基础知识的理解掌握.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
15.废水中CrO42-浓度降至5.0×10-7mol•L-1以下才能排放.含CrO42-的废水可用沉淀法处理:加入可溶性钡盐生成BaCrO4沉淀,再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于(已知:Ksp(BaCrO4)=1.2×10-10)( )
| A. | 1.2×10-5 mol•L-1 | B. | 2.4×10-4 mol•L-1 | ||
| C. | 3.6×10-4 mol•L-1 | D. | 4.8×10-4 mol•L-1 |
12.各取1mol 下列物质与溴水充分反应,消耗Br2的物质的量按①②顺序排列正确的是( )
①漆酚: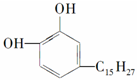 ②白藜芦醇
②白藜芦醇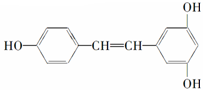
①漆酚:
 ②白藜芦醇
②白藜芦醇
| A. | 2mol、6mol | B. | 5mol、6mol | C. | 4mol、5mol | D. | 3mol、6mol |
19.下列与实验现象对应的结论正确的是( )
| 选项 | 实验操作 | 实现现象 | 结论 |
| A | 向浓度均为0.1mol/L NaCl、KI混合液中逐滴加入AgNO3溶液 | 先出现黄色沉淀 | 溶解性:AgCl>AgI |
| B | 溴乙烷与NaOH的乙醇溶液共热,将逸出气体通入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 证明有乙烯生成 |
| C | 向X的溶液中滴入浓NaOH溶液,将干燥红色石蕊试纸置于管口 | 无明显现象 | X溶液中无NH4+ |
| D | 将SO2气体通入Ba(NO3)2溶液 | 产生白色沉淀 | 沉淀为BaSO3 |
| A. | A | B. | B | C. | C | D. | D |
9.以下物质:(1)甲烷;(2)苯;(3)聚乙烯;(4)2-丁炔;(5)环己烷;(6)邻二甲苯;(7)苯乙烯.既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
| A. | (3)(4)(5) | B. | (4)(5)(7) | C. | (4)(7) | D. | (3)(4)(5)(7) |
16.短周期元素X、Y的原子序数相差2,下列叙述正确的是( )
| A. | X与Y不可能位于同一周期 | |
| B. | X与Y不可能形成原子个数比为1:1型离子化合物 | |
| C. | X离子与Y离子的电子层结构可以相同 | |
| D. | X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构 |
13.2014年7月31日中国经济网:河北省开展“环保亮剑”专项整治行动,强化“三废”治理.某工厂废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等成分,回收废渣中的金属元素的工艺流程如图所示:
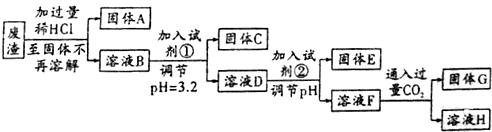
己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
(1)试剂①为C,试剂②为B;
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).

己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
 )的二氯取代物有10种,则萘的六氯代物有10.
)的二氯取代物有10种,则萘的六氯代物有10. 、
、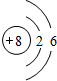 .
.