题目内容
2.硫酸是一种重要的含氧酸.实验室用浓硫酸与乙二酸(H2C2O4)晶体花热,可获得CO与CO2的混合气体,再将混合气体进一步通过碱石灰(填一种试剂的名称)即可得纯净干燥的CO.分析 CO与CO2的混合气体,二氧化碳与碱反应,而CO不能,以此来解答.
解答 解:二氧化碳与碱反应,而CO不能,则将混合气体进一步通过碱石灰,即可得纯净干燥的CO,故答案为:碱石灰.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质与性质差异为解答的关键,侧重分析与应用能力考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
12.各取1mol 下列物质与溴水充分反应,消耗Br2的物质的量按①②顺序排列正确的是( )
①漆酚: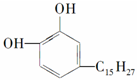 ②白藜芦醇
②白藜芦醇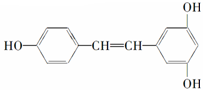
①漆酚:
 ②白藜芦醇
②白藜芦醇
| A. | 2mol、6mol | B. | 5mol、6mol | C. | 4mol、5mol | D. | 3mol、6mol |
13.2014年7月31日中国经济网:河北省开展“环保亮剑”专项整治行动,强化“三废”治理.某工厂废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等成分,回收废渣中的金属元素的工艺流程如图所示:
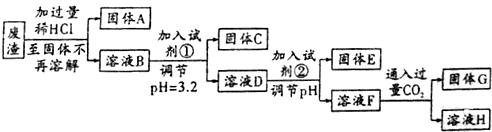
己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
(1)试剂①为C,试剂②为B;
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).

己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
10.下列关于SiO2和金刚石的叙述正确的是( )
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 12g金刚石含4molC-C键 | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
17.最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 辛烯和3-甲基-1-丁烯 | B. | 苯和乙炔 | ||
| C. | 2-甲基-3-乙基-1-戊烯和环丙烷 | D. | 软脂酸和硬脂酸 |
11.已知原子序数为a的ⅡA族元素X和原子序数为b的ⅢA族元素Y位于元素周期表中同一周期,下列的量值关系不正确的是( )
| A. | b=a+34 | B. | a=b-11 | C. | b=a+25 | D. | a=b-1 |
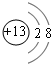 、
、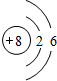 .
. ;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.
;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.