题目内容
5.某原子的外围电子排布式为3d14S2,下列说法正确的是( )| A. | 该元素位于元素周期表第三周期表ⅢB族 | |
| B. | 该元素位于s区 | |
| C. | 该元素为金属元素 | |
| D. | 该元素原子M能层共有8个电子 |
分析 若某基态原子的外围电子排布式为3d14s2,应为Sc元素,其核外有21个电子,位于周期表第四周期、第ⅢB族,以此解答该题.
解答 解:若某基态原子的外围电子排布式为3d14s2,应为Sc元素,其核外有21个电子,根据核外电子排布规律,该元素基态原子的电子排布式为1s22s22p63s23p63d14s2.
A.该原子外围电子排布式为3d14s2,位于周期表第四周期、第ⅢB族,故A错误;
B.该原子外围电子排布式为3d14s2,位于周期表第四周期、第ⅢB族,属于d区,故B错误;
C.为过渡金属元素,故C正确;
D.由电子排布式可知M层有9个电子,故D错误.
故选C.
点评 本题考查原子核外电子排布,题目难度不大,本题注意元素价层电子排布特点以及与在周期表位置的关系,熟练掌握元素周期表的结构.

练习册系列答案
相关题目
15.废水中CrO42-浓度降至5.0×10-7mol•L-1以下才能排放.含CrO42-的废水可用沉淀法处理:加入可溶性钡盐生成BaCrO4沉淀,再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于(已知:Ksp(BaCrO4)=1.2×10-10)( )
| A. | 1.2×10-5 mol•L-1 | B. | 2.4×10-4 mol•L-1 | ||
| C. | 3.6×10-4 mol•L-1 | D. | 4.8×10-4 mol•L-1 |
16.短周期元素X、Y的原子序数相差2,下列叙述正确的是( )
| A. | X与Y不可能位于同一周期 | |
| B. | X与Y不可能形成原子个数比为1:1型离子化合物 | |
| C. | X离子与Y离子的电子层结构可以相同 | |
| D. | X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构 |
13.2014年7月31日中国经济网:河北省开展“环保亮剑”专项整治行动,强化“三废”治理.某工厂废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等成分,回收废渣中的金属元素的工艺流程如图所示:
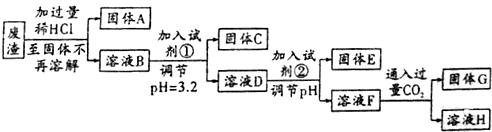
己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
(1)试剂①为C,试剂②为B;
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).

己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
20.有6种物质:①甲烷 ②苯 ③聚乙烯 ④乙烯 ⑤甲苯⑥己炔,既能使酸性高锰酸钾溶液褪色又能与溴水发生化学反应使之褪色的是( )
| A. | ③④ | B. | ③④⑥ | C. | ④⑤ | D. | ④⑥ |
10.下列关于SiO2和金刚石的叙述正确的是( )
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 12g金刚石含4molC-C键 | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
17.最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 辛烯和3-甲基-1-丁烯 | B. | 苯和乙炔 | ||
| C. | 2-甲基-3-乙基-1-戊烯和环丙烷 | D. | 软脂酸和硬脂酸 |
15.金属的用途和性质紧密相关.
(1)已知金属的物理性质有①导电性、②导热性、③延展性.请填表.
(2)铝是一种活泼金属,具有较强的还原性.
①金属铝在高温下与三氧化二铁反应,2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,称为铝热反应.该反应中Fe2O3是氧化剂,Al是还原剂.
②铝热反应不仅被用作焊接钢轨,还常用于冶炼熔点较高的金属,如钒、镉、锰等.用铝热反应原理从V2O5冶炼金属钒(V)的化学方程式为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(1)已知金属的物理性质有①导电性、②导热性、③延展性.请填表.
| 金属的用途 | 对应的金属物理性质 |
| 金可制成比纸还薄的金箔 | ③ |
| 用铁、铝等做炊具 | ② |
| 用铜制作印刷电路 | ① |
①金属铝在高温下与三氧化二铁反应,2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,称为铝热反应.该反应中Fe2O3是氧化剂,Al是还原剂.
②铝热反应不仅被用作焊接钢轨,还常用于冶炼熔点较高的金属,如钒、镉、锰等.用铝热反应原理从V2O5冶炼金属钒(V)的化学方程式为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
 、
、 .
.