题目内容
4.下列各组离子在饱和氯水中能大量共存的是( )| A. | Fe2+、Na+、Cl-、NO3- | B. | Na+、Al3+、SO42-、Cl- | ||
| C. | NH4+、K+、NO3-、S2- | D. | Na+、K+、HCO3-、SiO32- |
分析 A.氯水具有强氧化性,能够氧化亚铁离子;
B.四种离子之间不发生反应,都不与氯水反应;
C.硫离子具有还原性,能够被氯水氧化;
D.碳酸氢根离子、硅酸根离子能够与氯水中的氢离子反应.
解答 解:A.Fe2+能够被氯水氧化,在氯水中不能大量共存,故A错误;
B.Na+、Al3+、SO42-、Cl-之间不发生反应,都不与氯水反应,在溶液中能够大量共存,故B正确;
C.氯水具有强氧化性,能够氧化S2-,在溶液中不能大量共存,故C错误;
D.HCO3-、SiO32-与硫酸中的氢离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:氯水中含有氯气、次氯酸和氯化氢,所以氯水具有强氧化性、酸性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.金属的用途和性质紧密相关.
(1)已知金属的物理性质有①导电性、②导热性、③延展性.请填表.
(2)铝是一种活泼金属,具有较强的还原性.
①金属铝在高温下与三氧化二铁反应,2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,称为铝热反应.该反应中Fe2O3是氧化剂,Al是还原剂.
②铝热反应不仅被用作焊接钢轨,还常用于冶炼熔点较高的金属,如钒、镉、锰等.用铝热反应原理从V2O5冶炼金属钒(V)的化学方程式为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(1)已知金属的物理性质有①导电性、②导热性、③延展性.请填表.
| 金属的用途 | 对应的金属物理性质 |
| 金可制成比纸还薄的金箔 | ③ |
| 用铁、铝等做炊具 | ② |
| 用铜制作印刷电路 | ① |
①金属铝在高温下与三氧化二铁反应,2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,称为铝热反应.该反应中Fe2O3是氧化剂,Al是还原剂.
②铝热反应不仅被用作焊接钢轨,还常用于冶炼熔点较高的金属,如钒、镉、锰等.用铝热反应原理从V2O5冶炼金属钒(V)的化学方程式为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
19.用价层电子对互斥理论预测PH3和CH2O分子的立体结构,两个结论都正确的是( )
| A. | 平面三角形;平面三角形 | B. | 平面三角形;三角锥形 | ||
| C. | 三角锥形;平面三角形 | D. | 三角锥形;三角锥形 |
5.常温时,Ksp[Mg(OH)2]=1.1×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,Ksp(CH3COOAg)=2.3×10-3,下列叙述不正确的是( )
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
6.下列说法错误的是( )
| A. | 铅蓄电池工作时两极质量均增加 | |
| B. | Fe上镀Ag时,Ag接电源的正极 | |
| C. | 精炼铜时,阳极有0.2 molCu氧化阴极就有0.1 molCu2+被还原 | |
| D. | 用惰性电极电解饱和NaCl溶液和KNO3溶液,阴极都得到H2 |
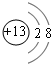 、
、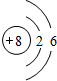 .
. ;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.
;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.