题目内容
16.NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.(1)如图1所示,利用电化学原理将NO2 转化为重要化工原料C.
若A为NO2,B为O2,则负极的电极反应式为:NO2+H2O-e-=NO3-+2H+;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-b kJ•mol-1;
H2O(g)═H2O(l)△H=-c kJ•mol-1;
CH3OH(g)═CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$b+2c-a-b)kJ•mol-1;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)制备.图2为此反应的反应速率随温度变化的曲线,图3为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线.回答下列问题:
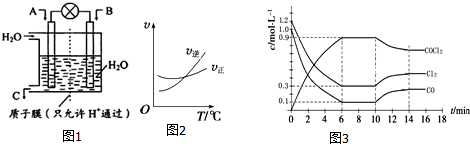
①0~6min内,反应的平均速率v(Cl2)=0.15 mol•L-1•min -1;
②若将初始投料浓度变为c(Cl2)=0.9mol/L、c(CO)=0.7mol/L、c(COCl2)=0.3 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
③随温度降低,该反应平衡常数变化的趋势是增大;(填“增大”、“减小”或“不变”)
④比较第9min反应温度T(9)与第16min反应温度T(16)的高低:T(9)<T(16) (填“<”、“>”或“=”).
⑤比较第9min反应速度V(9)与第16min反应速率v(16)的高低:v(9)<v(16) (填“<”、“>”或“=”).
分析 (1)由图可知,若A为NO2,B为O2,负极上NO2失去电子生成硝酸;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H=-b kJ•mol-1;
③H2O(g)═H2O(l)△H=-c kJ•mol-1;
④CH3OH(g)═CH3OH(l)△H=-d kJ•mol-1,
由盖斯定律可知,②×$\frac{3}{2}$+③×2-①-④得到CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);
(3)①由图可知,△c(Cl2)=1.2mol/L-0.3mol/L,结合v=$\frac{△c}{△t}$计算;
②温度不变,Cl2的体积分数相同,则极限转化后c(Cl2)=1.2mol/L;
③由图2可知,升高温度,逆反应速率大于正反应速率,则升高温度平衡逆向移动;
④正反应为放热反应,由图可知10min改变条件使平衡正向移动;
⑤第9min与第16min时均为平衡状态,但温度越高,反应速率越快.
解答 解:(1)NO2 在负极失去电子转化为NO3-,故电极反应为NO2+H2O-e-=NO3-+2H+,故答案为:NO2+H2O-e-=NO3-+2H+;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H=-b kJ•mol-1;
③H2O(g)═H2O(l)△H=-c kJ•mol-1;
④CH3OH(g)═CH3OH(l)△H=-d kJ•mol-1,
由盖斯定律可知,②×$\frac{3}{2}$+③×2-①-④得到CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$b+2c-a-b)kJ•mol-1,
则CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$b+2c-a-b)kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$b+2c-a-b)kJ•mol-1;
(3)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L-0.3mol/L=0.9mol/L,则v(Cl2)=$\frac{0.9mol/L}{6min}$=0.15 mol•L-1•min -1,
故答案为:0.15 mol•L-1•min -1;
②最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同,即与开始平衡为等效平衡,完全转化到左边满足Cl2浓度为1.2mol/L、CO浓度为1.0mol/L,则:0.9mol/L+c(COCl2)=1.2mol/L,c(CO)=0.7mol/L+c(COCl2)=1.0mol/L,故c(COCl2)=0.3mol/L,
故答案为:0.3;
③由图2可知,升温平衡向逆反应方向移动,正反应为放热反应,所以温度高,平衡常数减小,随温度降低,该反应平衡常数变化的趋势是增大,故答案为:增大;
④正反应为放热反应,根据图象,第9min反应处于平衡状态,在第10分钟时是改变条件使反应向逆方向移动,可知16min时放出热量更多,温度更高,故T(9)<T(16),故答案为:<;
⑤温度越高反应速率越快,结合④可知,T(9)<T(16),所以v(9)<v(16),故答案为:<.
点评 本题考查化学平衡计算及图象,为高频考点,把握图中浓度变化、盖斯定律应用、反应中能量变化、电极反应为解答的关键,侧重分析与计算能力的考查,注意图象分析与应用,综合性较强,题目难度不大.

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案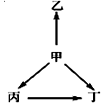 下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 | |
| A | S | SO2 | SO3 | H2SO4 | |
| B | N2 | NH3 | NO | NO2 | |
| C | CuO | Cu | Cu(OH)2 | CuCl2 | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | AgCl在饱和NaCl溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP (AgCl)<KSP (AgBr) | |
| C. | 将0.001 mol•L- 1 的AgNO3 溶液滴入0.001 mol•L- 1 的KCl和0.001 mol•L- 1 的K2CrO4 溶液中先产生Ag2CrO4 沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
反应时间(t)与容器内气体总压强(p)的数据见表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
(1)欲提高A的平衡转化率,应采取的措施为升高温度、降低压强;(写出两项措施).
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为($\frac{P}{{P}_{0}}$-1)×100%.平衡时A的转化率为94.1%,列式并计算反应的平衡常数K1.5mol/L.
(3)由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=$\frac{0.10P}{{P}_{0}}$ mol,n(A)=0.10×(2-$\frac{P}{P0}$) mol.
| A. | 及时把生成的氨液化分离 | B. | 升温有利于氨的生成 | ||
| C. | 使用催化剂促进氮的转化 | D. | 增大压强,不利于氨的生成 |
| t/min | 1 | 4 | 8 | 11 |
| n(H2)mol | 6 | 2.6 | 2 | 2 |
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
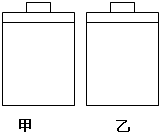 常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
| A. | (a)甲>乙,(b)甲>乙 | B. | (a)甲>乙,(b)甲=乙 | C. | (a)甲<乙,(b)甲>乙 | D. | (a)甲>乙,(b)甲<乙 |

| A. | ①将海带灼烧成灰 | B. | ②过滤海带灰得到含I-的溶液 | ||
| C. | ③放出碘的苯溶液 | D. | ④分离碘并回收苯 |
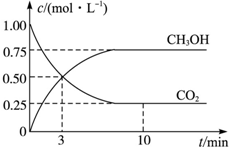 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.