题目内容
16.镍配合物在传感器、磁记录材料、储氢材料等方面有着广泛的应用.以镍片为原料制备一种镍配合物[Ni(NH3)x]Cl2的主要流程如下: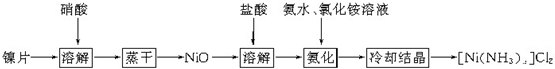
(1)已知镍片与浓、稀硝酸都能反应,该流程中若选用浓硝酸,其优点是反应快,易蒸干,若选用稀硝酸,其优点是溶解单位质量的镍所耗HNO3质量少.
(2)准确称取0.232g[Ni(NH3)x]Cl2样品,溶于水后加入2.00mL 6mol•L-1 HCl,用0.25mol•L-1 NaOH溶液中和过量的盐酸,消耗NaOH溶液24.00mL.通过计算确定x的值.已知:[Ni(NH3)x]Cl2+xHCl=NiCl2+xNH4Cl (写出解题过程)
(3)若在[Ni(NH3)x]Cl2样品中存在Ni(OH)2杂质,则上述实验测定的x值偏小(填“偏大”、“偏小”或“不变”).
分析 镍片加入硝酸溶解后蒸干得到NiO,加入盐酸溶解后加入氨水、氯化铵溶液氨化,冷却结晶得到镍配合物[Ni(NH3)x]Cl2,
(1)根据浓度越大,化学反应速率越快;浓硝酸和稀硝酸相比,溶解单位质量的镍所耗稀HNO3质量少;
(2)先根据NaOH~HCl计算出过量的盐酸,然后 Ni(NH3)xCl2~XHCl计算出X;
(3)根据Ni(OH)2能与盐酸反应1:2反应,而Ni(NH3)x]Cl2能与盐酸1:6反应,采用极限法分析即可.
解答 解:(1)浓硝酸浓度大,反应快,易蒸干;浓硝酸和稀硝酸相比,溶解单位质量的镍所耗稀HNO3质量少,
故答案为:反应快,易蒸干;溶解单位质量的镍所耗稀HNO3质量少;
(2)NaOH~~~~~~~HCl
1 1
0.25mol.L-1×0.024L 0.006mol
参加反应的盐酸为:0.002L×6mol.L-1-0.006mol=0.006mol;
Ni(NH3)x]Cl2 ~xHCl
1 x
$\frac{0.232g}{(59+17X+71)g/mol}$ 0.006mol;
解得:x=6,故答案为:6;
(3)Ni(OH)2能与盐酸反应1:2反应,而Ni(NH3)x]Cl2能与盐酸1:6反应,所以若在[Ni(NH3)x]Cl2样品中存在Ni(OH)2杂质,样品与盐酸的比大于1:6,即x值偏小,故选偏小.
故答案为:偏小.
点评 本题主要考查了沉淀的溶解平衡以及化学计算,题目难度中等,根据课本知识即可完成.

练习册系列答案
相关题目
6.根据测定硫酸铜晶体中结晶水含量的实验,填写下列空白:
(1)本实验至少需要加热2次.至少需要称量4次.
(2)通过实验知道,要确保结果的准确性,本实验中的一个关键是通过恒重操作来判断硫酸铜晶体加热时是否完全变成无水硫酸铜.
(3)学生甲实验得到以下的数据:
甲学生结晶水数量的测定值5.23(保留2位小数)
(4)若学生乙的实验结果偏低,从下列选项中选出造成结果偏低的可能原因de(填序号).
a.加热前称量时坩埚未完全干燥 b.加热过程中有少量晶体溅出
c.加热时坩埚内物质变黑 d.加热后放在空气中冷却
e.最后两次加热后称量的质量差大于0.001g.
(1)本实验至少需要加热2次.至少需要称量4次.
(2)通过实验知道,要确保结果的准确性,本实验中的一个关键是通过恒重操作来判断硫酸铜晶体加热时是否完全变成无水硫酸铜.
(3)学生甲实验得到以下的数据:
| 坩埚质量(g) | 坩埚和晶体的总质量(g) | 加热后坩埚和剩余固体的质量(g) |
| 11.685 | 13.691 | 12.948 |
(4)若学生乙的实验结果偏低,从下列选项中选出造成结果偏低的可能原因de(填序号).
a.加热前称量时坩埚未完全干燥 b.加热过程中有少量晶体溅出
c.加热时坩埚内物质变黑 d.加热后放在空气中冷却
e.最后两次加热后称量的质量差大于0.001g.
8.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH•H2O═AlO2-+4NH4++2H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
5.下列说法正确的是( )
| A. | 置换反应不一定全部是氧化还原反应 | |
| B. | 氧化还原反应中氧化剂和还原剂可以是同种物质 | |
| C. | 氧化反应和还原反应不一定同时发生 | |
| D. | 还原剂是得电子,氧化剂失电子 |
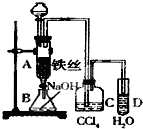 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.