题目内容
1.下列有关化学反应的描述中不正确的是( )| A. | 一定条件下的可逆反应,反应物的转化率不可能达到100% | |
| B. | △H<0,△S>0的化学反应一定能自发进行 | |
| C. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| D. | 同一反应中,△H的大小与化学反应中参加反应的物质的量无关 |
分析 A、可逆反应具有不完全性;
B、△H-T△S<0的反应能够自发进行;
C、燃烧热的含义:完全燃烧1mol物质生成最稳定的氧化物所放出的能量,碳燃烧生成稳定氧化物是二氧化碳;
D、△H与反应方程式的系数成正比,与参加反应的物质的物质的量无关.
解答 解;A、可逆反应具有不完全性,反应物的转化率不可能达到100%,故A正确;
B、△H-T△S<0的反应能够自发进行,则△H<0,△S>0的反应一定能自发进行,故B正确;
C、燃烧热的含义:完全燃烧1mol物质生成最稳定的氧化物所放出的能量,碳的燃烧热应该是生成二氧化碳时所放出的能量,故C错误;
D、△H与反应方程式的系数成正比,与参加反应的物质的物质的量无关,故D正确;
故选C.
点评 本题考查可逆反应、反应的方向、燃烧热的含义以及△H等知识,难度不大,注意基础知识积累掌握.

练习册系列答案
相关题目
12.某盐酸试剂瓶上的标签如图.下列有关说法正确的为( )


| A. | 该浓度的盐酸可以用广口瓶盛装 | |
| B. | 该试剂的物质的量浓度为11.9mol/L | |
| C. | 用该盐酸配制250毫升2.0摩尔、升的稀盐酸时需要选用100毫升量筒 | |
| D. | 该盐酸中所含Cl-数目为5.95NA |
9.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 第一电离能:Na<Mg<Al<Si |
16.0.1mol化合物甲在足量的氧气中完全燃烧后生成4.48LCO2(标况下测量),推测甲是( )
| A. | CH4 | B. | C2H4 | C. | C3H8 | D. | C6H6 |
6.某原电池总反应的离子方程式为 2Fe3++Fe=3Fe2+,能实现该反应的原电池是( )
| A. | 正极为 Cu,负极为 Fe,电解质为 FeCl3 溶液 | |
| B. | 正极为Fe,负极为Zn,电解质为 Fe(NO3)3 溶液 | |
| C. | 正极为 Fe,负极为 Zn,电解质为 FeSO4 溶液 | |
| D. | 正极为 Ag,负极为 Fe,电解质为 CuSO4 溶液 |
13. 如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
 如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
如图,B为常见金属或非金属单质,有下列转化关系.若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )| A. | CuCl2 | B. | AlCl3 | C. | H2O2 | D. | NaCl |
 .
. 氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题:
氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题: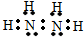 .
.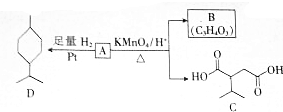
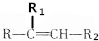 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$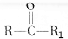 +R2COOH
+R2COOH .A与等物质的量的溴单质反应的产物有3种.
.A与等物质的量的溴单质反应的产物有3种. .
.