题目内容
16.0.1mol化合物甲在足量的氧气中完全燃烧后生成4.48LCO2(标况下测量),推测甲是( )| A. | CH4 | B. | C2H4 | C. | C3H8 | D. | C6H6 |
分析 先根据标准状况下的气体摩尔体积计算出4.48L二氧化碳的物质的量,然后根据碳原子守恒计算出1mol该化合物中含有的碳原子的物质的量,从而确定该有机物分子中含有的碳原子数目,最后根据选项中碳原子数目进行判断.
解答 解:标准状况下4.48LCO2的物质的量为:n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
即:0.1mol甲完全燃烧生成了0.2mol二氧化碳,根据碳原子守恒,则0.1mol甲中含有0.2molC,
1mol化合物甲中含有碳原子的物质的量为:n(C)=$\frac{0.2}{0.1}$mol=2mol,
所以化合物甲中含有2个C原子,选项中只有B选项中的分子含有两个C,
故选B.
点评 本题考查了确定有机物分子式的计算方法,题目难度不大,注意掌握确定有机物分子式、结构简式的方法,明确质量守恒、烃的燃烧通式确定有机物分子组成的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O |
4.在蒸发器中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
| A. | CuCl2 | B. | 碳酸氢钾 | C. | 硫酸镁 | D. | 硝酸银 |
1.下列有关化学反应的描述中不正确的是( )
| A. | 一定条件下的可逆反应,反应物的转化率不可能达到100% | |
| B. | △H<0,△S>0的化学反应一定能自发进行 | |
| C. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| D. | 同一反应中,△H的大小与化学反应中参加反应的物质的量无关 |
8.某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
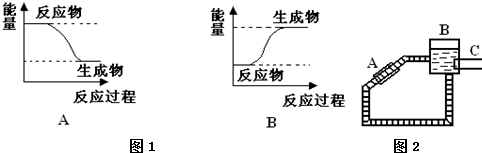
(1)若E1>E2,则该反应为放热(填“放热”或“吸热”)反应.该反应可用图1A(填“A”或“B”)表示.
(2)太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
其中最适宜作储能介质的一种盐是B(填字母).
A.CaCl2•6H2OB.Na2SO4•10H2O
C.Na2HPO4•12H2OD.Na2S2O3•5H2O
②图2是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.
根据对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.

(1)若E1>E2,则该反应为放热(填“放热”或“吸热”)反应.该反应可用图1A(填“A”或“B”)表示.
(2)太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
A.CaCl2•6H2OB.Na2SO4•10H2O
C.Na2HPO4•12H2OD.Na2S2O3•5H2O
②图2是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.
根据对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.