题目内容
12.某盐酸试剂瓶上的标签如图.下列有关说法正确的为( )
| A. | 该浓度的盐酸可以用广口瓶盛装 | |
| B. | 该试剂的物质的量浓度为11.9mol/L | |
| C. | 用该盐酸配制250毫升2.0摩尔、升的稀盐酸时需要选用100毫升量筒 | |
| D. | 该盐酸中所含Cl-数目为5.95NA |
分析 A、溶液用细口瓶盛装;
B、物质的量浓度C=$\frac{1000ρω%}{M}$;
C、求出配制250mL2mol/L的稀盐酸所需的浓盐酸的体积,然后根据大而近的原则选取量筒;
D、溶液体积不明确.
解答 解:A、溶液用细口瓶盛装,而不同广口瓶,故A错误;
B、该试剂的物质的量浓度C=$\frac{1000ρω%}{M}$=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,故B正确;
C、设配制250mL2mol/L的稀盐酸所需的浓盐酸的体积为VmL,根据稀释定律可知:
11.9mol/L×VmL=2mol/L×250mL
解得V=42.0mL
根据大而近的原则,应选取50mL量筒,故C错误;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选B.
点评 本题考查了物质的量浓度的计算和配制一定物质的量浓度溶液所需浓溶液体积的有关计算,难度不大,应注意物质的量浓度计算公式的应用.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
2.下列有关物理量相应的单位表达正确的是( )
| A. | 摩尔质量g• | B. | 气体摩尔体积mol•L-1 | ||
| C. | 物质的量•mol-1 | D. | 物质的量浓度:mol/L |
3.下列是元素周期表的短周期中的部分元素
(1)表中元素,原子半径最大的是Na,原子半径最小的是H.(不包括稀有气体元素.填空均用元素符号或化学式回答,下同)
(2)金属性最强的是Na;化学性质最不活泼的是Ne;最高正价和负价的绝对值相等的是C;氢化物水溶液呈碱性的是NH3.
(3)I和L最高价氧化物对应的水化物酸性较强的是HClO4,判断依据之一是HCl比H2S更稳定(或Cl2与H2化合比S与H2化和更容易).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | L |
(2)金属性最强的是Na;化学性质最不活泼的是Ne;最高正价和负价的绝对值相等的是C;氢化物水溶液呈碱性的是NH3.
(3)I和L最高价氧化物对应的水化物酸性较强的是HClO4,判断依据之一是HCl比H2S更稳定(或Cl2与H2化合比S与H2化和更容易).
20.下列对能量转化的认识中,不正确的是( )
| A. | 电解水生成氢气和氧气时,其能量转化主要是电能转化为化学能 | |
| B. | 某反应的反应物总能量低于生成物总能量,其能量转化主要是热能转化为化学能 | |
| C. | 大多数置换反应发生时,其能量转化主要是化学能转化为热能 | |
| D. | 铅蓄电池放电时,其能量转化主要是电能转化为化学能 |
7.下列离子方程式书写正确的是( )
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O |
4.在蒸发器中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
| A. | CuCl2 | B. | 碳酸氢钾 | C. | 硫酸镁 | D. | 硝酸银 |
1.下列有关化学反应的描述中不正确的是( )
| A. | 一定条件下的可逆反应,反应物的转化率不可能达到100% | |
| B. | △H<0,△S>0的化学反应一定能自发进行 | |
| C. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| D. | 同一反应中,△H的大小与化学反应中参加反应的物质的量无关 |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g | |
| C. | 常温常压下,1.6 g CH4含原子数为0.5NA | |
| D. | 4 g金属钙变成钙离子时失去的电子数目为0.1 NA |
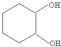 ,其过程如下:
,其过程如下: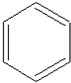 $→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→
$→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→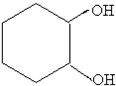
 ;
;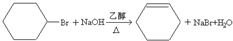 ;
; ;
; .
.