题目内容
6.某原电池总反应的离子方程式为 2Fe3++Fe=3Fe2+,能实现该反应的原电池是( )| A. | 正极为 Cu,负极为 Fe,电解质为 FeCl3 溶液 | |
| B. | 正极为Fe,负极为Zn,电解质为 Fe(NO3)3 溶液 | |
| C. | 正极为 Fe,负极为 Zn,电解质为 FeSO4 溶液 | |
| D. | 正极为 Ag,负极为 Fe,电解质为 CuSO4 溶液 |
分析 该原电池总反应的离子方程式为 2Fe3++Fe=3Fe2+,铁离子得电子被还原,则可溶性铁盐溶液为电解质溶液,Fe失电子发生氧化反应,则Fe作负极,不如Fe活泼的金属或导电的非金属作正极,据此分析解答.
解答 解:该原电池总反应的离子方程式为 2Fe3++Fe=3Fe2+,铁离子得电子被还原,则可溶性铁盐溶液为电解质溶液,Fe失电子发生氧化反应,则Fe作负极,不如Fe活泼的金属或导电的非金属作正极,
A.Fe作负极、Cu作正极、氯化铁溶液为电解质溶液,符合题给信息,故A正确;
B.活泼性Zn>Fe,则不能用Zn作负极,故B错误;
C.活泼性Zn>Fe,且电解质是硫酸亚铁,不符合题给信息,故C错误;
D.电解质为硫酸铜,应该为可溶性铁盐,故D错误;
故选A.
点评 本题考查原电池设计,为高频考点,明确原电池原理是解本题关键,侧重考查学生实验设计能力及对原电池原理的理解和掌握,注意正负极材料的判断方法,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
16.已知维生素A的结构简式为:

关于它的叙述正确的是( )

关于它的叙述正确的是( )
| A. | 维生素A的分子式为C20H32O | |
| B. | 维生素A可被催化氧化为醛 | |
| C. | 维生素A是一种易溶于水的醇 | |
| D. | 1mol维生素A在催化剂作用下最多可与7mol H2发生加成反应 |
14.下列说法正确的是( )
| A. | 铜基态原子核外电子排布式为1s22s22p63s23p64s13d10 | |
| B. | 在d轨道中电子排布成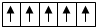 而不是 而不是 ,其最直接的根据是泡利原理 ,其最直接的根据是泡利原理 | |
| C. | 下列轨道的能量是按由高到低排列的E5s>E4s>E3d>E2p>E1s | |
| D. | 焰色反应、激光、霓虹灯光等与原子核外电子发生跃迁释放能量有关 |
1.下列有关化学反应的描述中不正确的是( )
| A. | 一定条件下的可逆反应,反应物的转化率不可能达到100% | |
| B. | △H<0,△S>0的化学反应一定能自发进行 | |
| C. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| D. | 同一反应中,△H的大小与化学反应中参加反应的物质的量无关 |
11.下列气体中,既能用碱石灰干燥,又能用排水法收集的是( )
| A. | CO | B. | NO2 | C. | SO2 | D. | NH3 |
18.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 1 L 0.1 mol•L-1的乙醇溶液中分子总数为0.1NA | |
| B. | 常温常压下,28 g乙烯含有的电子数为16NA | |
| C. | 44g乙酸乙酯和丁酸的混合物中共含有碳原子数为2 NA | |
| D. | m g丙烯和戊烯的混合物中共用电子对数为$\frac{3m}{14}$NA |
2.硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等,以下是工业利用硫酸钙的部分流程(图1):

(1)工业生产中产生的含SO2废气经石灰吸收和氧化后制成硫酸钙,写出反应方程式2SO2+2Ca(OH)2+O2=2CaSO4+2H2O.
(2)装置Ⅱ中,在一定条件下,二氧化硫和氧气发生反应时,温度与二氧化硫的转化率的关系如表所示:
①该反应的平衡常数表达式K=$\frac{c(SO{\;}_{3}){\;}^{2}}{c(SO{\;}_{2}){\;}^{2}c(O{\;}_{2})}$.
②关于此反应下列说法正确的是ac(填字母).
a.该反应△H<0
b.反应达到平衡时,SO2,O2,SO3 的浓度一定都相等
c.反应达到平衡状态时,v(SO2)正=2v(O2)逆
d.升高温度或使用催化剂都可提高SO2的转化率
③硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法.用氨水吸收上述尾气,若尾气中
SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是ac (填字母).
a.c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
b.c(NH4+)+c (H+)=c (SO32-)+c (HSO3-)+c (OH-)
c.c(NH4+)>c (SO32-)>c (OH-)>c (H+)
(3)装置Ⅲ中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).
已知:①2CO(g)+O2(g)═2CO2(g)△H=-283kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2CH3OH(l)+3O2(g)═2CO2(g)+4H2O (l)△H=-725.8kJ•mol-1
试写出CO与H2在一定条件下反应生成CH3OH(l)的热化学方程式CO(g)+2H2(g)=CH3OH(l)△H=-350.2kJ•mol-1.
(4)在固态金属氧化物电解池中,一定条件下H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图2所示.
①Y端是电源的正极(填正极或负极).
②阴极的电极反应式为 CO2+2eˉ=CO+O2ˉ和H2O+2e-═H2↑+O2-.

(1)工业生产中产生的含SO2废气经石灰吸收和氧化后制成硫酸钙,写出反应方程式2SO2+2Ca(OH)2+O2=2CaSO4+2H2O.
(2)装置Ⅱ中,在一定条件下,二氧化硫和氧气发生反应时,温度与二氧化硫的转化率的关系如表所示:
| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
②关于此反应下列说法正确的是ac(填字母).
a.该反应△H<0
b.反应达到平衡时,SO2,O2,SO3 的浓度一定都相等
c.反应达到平衡状态时,v(SO2)正=2v(O2)逆
d.升高温度或使用催化剂都可提高SO2的转化率
③硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法.用氨水吸收上述尾气,若尾气中
SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是ac (填字母).
a.c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
b.c(NH4+)+c (H+)=c (SO32-)+c (HSO3-)+c (OH-)
c.c(NH4+)>c (SO32-)>c (OH-)>c (H+)
(3)装置Ⅲ中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).
已知:①2CO(g)+O2(g)═2CO2(g)△H=-283kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2CH3OH(l)+3O2(g)═2CO2(g)+4H2O (l)△H=-725.8kJ•mol-1
试写出CO与H2在一定条件下反应生成CH3OH(l)的热化学方程式CO(g)+2H2(g)=CH3OH(l)△H=-350.2kJ•mol-1.
(4)在固态金属氧化物电解池中,一定条件下H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图2所示.
①Y端是电源的正极(填正极或负极).
②阴极的电极反应式为 CO2+2eˉ=CO+O2ˉ和H2O+2e-═H2↑+O2-.
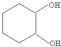 ,其过程如下:
,其过程如下: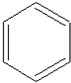 $→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→
$→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→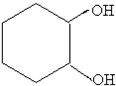
 ;
;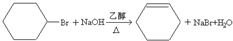 ;
; ;
;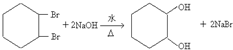 .
.