题目内容
用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略).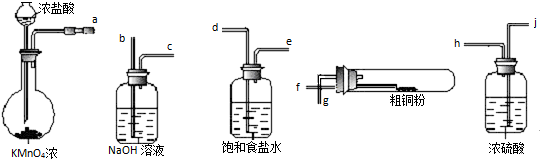
①按气流方向连接各仪器接口顺序是:a→ .
②反应时,盛粗铜粉的试管中的现象是 .
③已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)?CuCl42-(aq)+4H2O (l)
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是
(填序号).
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失.

①按气流方向连接各仪器接口顺序是:a→
②反应时,盛粗铜粉的试管中的现象是
③已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)?CuCl42-(aq)+4H2O (l)
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失.
考点:氯气的实验室制法,氯气的化学性质
专题:
分析:(1)①要制备收集纯净的氯气应该除去氯气中的杂质(水、HCl),除氯化氢用饱和食盐水,除去水用浓硫酸,然后与铜反应,最后尾气处理用氢氧化钠,据此解答;
②粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟;
③A.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系;
B.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系;
C.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系;
D.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系;
②粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟;
③A.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系;
B.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系;
C.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系;
D.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系;
解答:
解:(1)①从a出来的气体含有氯化氢和水蒸气,依次通过d e j h 除去氯化氢和水蒸气,然后与铜反应,最后尾气处理用氢氧化钠,则依次再通过f g b c,所以按照气流方向各仪器接口的连接顺序为a→d→e→j→h→f→g→b→c,故答案为:a→d→e→j→h→f→g→b→c;
②粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟,故答案为:铜粉逐渐减少并生成大量棕黄色的烟;
③A.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故A正确;
B.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故B正确;
C.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故C正确;
D.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故D错误.
故答案为:ABC.
②粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟,故答案为:铜粉逐渐减少并生成大量棕黄色的烟;
③A.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故A正确;
B.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故B正确;
C.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故C正确;
D.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故D错误.
故答案为:ABC.
点评:本题考查考查较为综合,涉及物质的制备和性质实验设计等问题,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
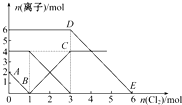 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、线段AB表示Fe2+被氯气氧化 |
| C、线段BC表示生成4 mol Fe3+ |
| D、原溶液中n(Br-)=6 mol |
可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是:( )
①一个N≡N键断裂的同时,有3个H-H键断裂
②其它条件不变时,混合气体平均式量不再改变
③保持其它条件不变时,体系压强不再改变
④恒温恒容时,密度保持不变
⑤NH3%不再改变
⑥2υ正(H2)=3υ逆(NH3)
⑦容器内三种气体共存
⑧N2、H2、NH3分子式之比为1:3:2.
①一个N≡N键断裂的同时,有3个H-H键断裂
②其它条件不变时,混合气体平均式量不再改变
③保持其它条件不变时,体系压强不再改变
④恒温恒容时,密度保持不变
⑤NH3%不再改变
⑥2υ正(H2)=3υ逆(NH3)
⑦容器内三种气体共存
⑧N2、H2、NH3分子式之比为1:3:2.
| A、全部 | B、只有①③⑤ |
| C、②③⑤⑥ | D、只有③⑤⑥ |
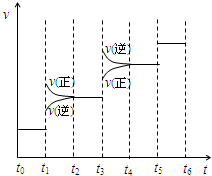
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
| A、由图可知:T1<T2,且该反应为吸热反应 |
| B、T2时该反应的平衡常数K=0.8 |
| C、前10min乙、丙两容器中v(A)乙>v(A)丙 |
| D、C的质量m:m甲=m乙<2m丙 |
下列实验操作正确的是( )
| A、将氢氧化钠固体放在滤纸上称量 |
| B、用10 mL量筒量取8.58 mL蒸馏水 |
| C、硅酸钠溶液保存在橡胶塞的试剂瓶中 |
| D、用广泛pH试纸测定某浓度醋酸溶液的pH为4.5 |
下列事实,不能用勒夏特列原理解释的是( )
| A、氯水中有下列平衡:Cl2+H2O?HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 |
| B、对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
| C、反应CO+NO2?CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
| D、合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2+3H2?2NH3;△H<0) |
 氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.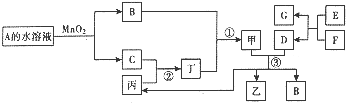 已知化合物A与B、丙与丁的组成元素相同,且四种物质中都含有同一种元素.A与B在常温下呈液态.D与F为常见金属单质,且D、F分别与甲的浓溶液分别在常温作用都无明显现象,加热时都有大量气体产生.E是一种红棕色粉末,A与丙可化合生成甲,乙、丙和B在常温下也可以生成甲和另一种化合物X,其部分转化关系如图(相关转化中部分反应条件和生成物未标出).
已知化合物A与B、丙与丁的组成元素相同,且四种物质中都含有同一种元素.A与B在常温下呈液态.D与F为常见金属单质,且D、F分别与甲的浓溶液分别在常温作用都无明显现象,加热时都有大量气体产生.E是一种红棕色粉末,A与丙可化合生成甲,乙、丙和B在常温下也可以生成甲和另一种化合物X,其部分转化关系如图(相关转化中部分反应条件和生成物未标出).