题目内容
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)?Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
| A、2v正(X)=v逆(Y) |
| B、单位时间内生成1 mol Y的同时生成2 mol X |
| C、混合气体的密度不再变化 |
| D、反应容器中Y的质量分数不变 |
考点:化学平衡状态的判断
专题:
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:A、x的分解速率属于正速率,Y的消耗速率属于逆速率,二者之比为2:1时,该反应达到平衡状态,速率之比等于化学方程式计算之比,v正(X)=2v逆(Y),说明反应达到平衡状态,2v正(X)=v逆(Y),不能说明反应达到平衡状态,故A符合;
B、单位时间内生成1molY为正速率,生成2molX为逆速率,而且正逆速率之比等于化学计量数之比,是平衡状态,故B不符合;
C、该反应是一个反应前后气体的质量改变的化学反应,当反应达到平衡状态时,混合气体的质量不再发生变化,容器的体积不变,导致混合气体的密度不再变化,所以该反应达到平衡状态,故C不符合;
D、根据平衡状态的概念可知,当反应混合物中各组成成分的百分含量保持不变时即是平衡状态,所以反应容器中Y的质量分数不变,是平衡状态,故D不符合;
故选A.
B、单位时间内生成1molY为正速率,生成2molX为逆速率,而且正逆速率之比等于化学计量数之比,是平衡状态,故B不符合;
C、该反应是一个反应前后气体的质量改变的化学反应,当反应达到平衡状态时,混合气体的质量不再发生变化,容器的体积不变,导致混合气体的密度不再变化,所以该反应达到平衡状态,故C不符合;
D、根据平衡状态的概念可知,当反应混合物中各组成成分的百分含量保持不变时即是平衡状态,所以反应容器中Y的质量分数不变,是平衡状态,故D不符合;
故选A.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
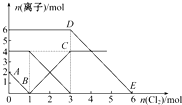 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、线段AB表示Fe2+被氯气氧化 |
| C、线段BC表示生成4 mol Fe3+ |
| D、原溶液中n(Br-)=6 mol |

