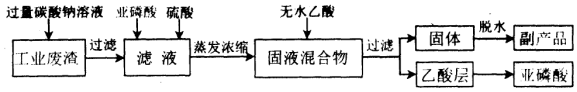
题目内容
7.已知:25℃,H2A的电离常数K1=6.0×10-2,K2=6.0×10-5,此温度下,将1mL浓度为0.1mL•L-1的H2A溶液加水稀释到1000mL,下列说法正确的是( )| A. | 上述稀释过程中,H2A分子及所有离子浓度均减小 | |
| B. | 上述稀释过程中,$\frac{{c(HA}^{-})}{{c(H}_{2}A)}$的变化趋势保持增大 | |
| C. | 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-) | |
| D. | 根据H2A的电离常数,可推知0.1mol•L-1NaHA溶液的pH值大于7 |
分析 A.H2A为弱酸溶液中存在电离平衡,加水稀释促进电离,平衡状态下离子浓度减小,温度不变溶液中存在离子积常数;
B.稀释溶液促进弱酸电离平衡正向进行,HA-离子数增多,H2A分子数减小;
C.溶液中存在电荷守恒,阴阳离子所带电荷数相同;
D.计算HA-离子水解平衡常数和HA-电离平衡常数比较判断电离程度和水解程度大小.
解答 解:A.上述稀释过程中,不是所有离子浓度均减小,氢离子浓度减小,氢氧根离子浓度增大,故A错误;
B.稀释溶液促进弱酸电离平衡正向进行,HA-离子数增多,H2A分子数减小,$\frac{c(H{A}^{-})}{c({H}_{2}A)}$比值增大,故B正确;
C.溶液中存在电荷守恒,c(H+)=c(OH-)+2c(A2-)+c(HA-),故C错误;
D.HA-水解离子方程式为:HA-+H2O?H2A+OH-,Kh=$\frac{c(O{H}^{-})c({H}_{2}A)}{c(H{A}^{-})}$=$\frac{c(O{H}^{-})c({H}_{2}A)}{c(H{A}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{1}}$=$\frac{1{0}^{-14}}{6.0×1{0}^{-2}}$=$\frac{1}{6}$×10-12,<K2 =6.0×10-5,电离程度大于其水解程度,溶液显酸性,故D错误;
故选B.
点评 本题考查了弱电解质电离平衡影响因素、电离平衡常数、水解离子平衡常数计算、电荷守恒应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.对于反应CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,在其他条件不变的情况下,下列说法正确的是( )
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 改变压强(压缩气体或扩大容积),平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
18.洪涝地区欲将河水转化为可饮用水,下列处理过程中较合理的顺序是( )
①化学沉降(加明矾);②消毒杀菌(用漂白粉);③自然沉降;④加热煮沸.
①化学沉降(加明矾);②消毒杀菌(用漂白粉);③自然沉降;④加热煮沸.
| A. | ②①④③ | B. | ③②①④ | C. | ③①②④ | D. | ③①④② |
15.不慎将油滴在衣服上,要除去油滴的方法通常为( )
| A. | 分液 | B. | 蒸馏 | C. | 过滤 | D. | 溶解 |
12.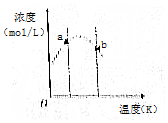 对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
 对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )| A. | 该反应的正反应是吸热反应 | B. | a处反应速率比b处反应速率大 | ||
| C. | 反应方程式中计量数x=1 | D. | b状态时:v(正)=v(逆) |
19.化学与生产、生活联系紧密,下列有关说法正确的是( )
| A. | 铵态氮肥和草木灰适宜混合使用 | |
| B. | 75%的酒精溶液可用作皮肤消毒剂 | |
| C. | SO2可用于漂白银耳 | |
| D. | 油脂和纤维素均可为人体提供能量. |
2. 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体,硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
(1)如图实验装置中仪器乙的名称为:冷凝管.装置B的作用是防C中液体倒吸进A中(安全瓶).
(2)检验淀粉是否水解完全的方法:取样,加碘水,看是否变蓝,变蓝则证明水解不完全,否则,水解完全.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快.为探究其原因,同学们做了如下对比实验;
由此你认为溶液褪色总是先慢后快的原因是Mn2+起了催化剂的作用.
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4•7H2O 固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解.向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置.倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干.
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是取最后一次洗涤液1~2mL置于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
②用丙酮洗涤固体两次的目的是降低草酸亚铁的溶解量,同时更快洗去表面的水分.
 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体,硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
(1)如图实验装置中仪器乙的名称为:冷凝管.装置B的作用是防C中液体倒吸进A中(安全瓶).
(2)检验淀粉是否水解完全的方法:取样,加碘水,看是否变蓝,变蓝则证明水解不完全,否则,水解完全.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快.为探究其原因,同学们做了如下对比实验;
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) | 褪色时间(S) | ||
| C(mol•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4•7H2O 固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解.向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置.倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干.
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是取最后一次洗涤液1~2mL置于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
②用丙酮洗涤固体两次的目的是降低草酸亚铁的溶解量,同时更快洗去表面的水分.
3.若用E表示某原子中各轨道的能量,下列轨道能量大小顺序正确的是( )
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(4s)>E(3d) | D. | E(5s)>E(4s)>E(4f) |