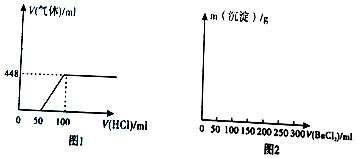
题目内容
2.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:下列说法正确的是( )| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(Cl2)=0.0016 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则该反应的△H<0 | |
| C. | 温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)<v(逆) | |
| D. | 温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,达到平衡时,PCl3的转化率小于80% |
分析 A.由表中数据可知50s内,△n(PCl3)=0.16mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(PCl3);
B.由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol,根据平衡时n(PCl3),判断平衡移动方向,升高温度平衡向吸热反应方向移动;
C.先求平衡常数K,再求浓度商(Qc),K>Qc,说明平衡向正反应方向移动,K<Qc,说明平衡向逆反应方向移动,K=Qc,说明平衡不移动,据此判断平衡移动;
D.等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,据此判断.
解答 解:A.由表中数据可知50s内,△n(PCl3)=0.16mol,v(PCl3)=$\frac{\frac{0.16mol}{2L}}{50s}$=0.0016mol/(L•s),故A错误;
B.由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×2L=0.22mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,故B错误;
C.对于反应:PCl5(g)?PCl3(g)+Cl2(g),
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
所以平衡常数k=$\frac{0.1×0.1}{0.4}$=0.025.
起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=$\frac{0.1×0.1}{0.5}$=0.02,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C错误;
D.温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,相当于在加入0.5molPCl5.减小压强,平衡逆向移动,则达到平衡时,达到平衡时,PCl3的物质的量大于0.1mol,则转化的小于0.4mol,PCl3的转化率小于80%,故D正确.
故选D.
点评 本题考查较为综合,涉及反应速率、平衡常数计算、平衡移动、等效平衡等,难度中等,注意D中使用等效平衡思想分析,使问题简单化,也可以根据平衡常数计算,但比较计算比较复杂.

| A. | 0.5 L | B. | 0.1 L | C. | 0.2 L | D. | 1 L |
| A. | $\frac{a}{2}$L | B. | $\frac{a}{3}$L | C. | $\frac{a}{4}$L | D. | $\frac{a}{5}$L |
| A. |  2-乙基丙烷 2-乙基丙烷 | B. |  异戊烷 异戊烷 | ||
| C. |  4,4-二甲基-2-戊炔 4,4-二甲基-2-戊炔 | D. |  环己酚 环己酚 |
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 改变压强(压缩气体或扩大容积),平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(l-) | amol | 0mol | 0mol |
(2)原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
| A. | 镁片与盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 酸碱中和反应 | D. | 乙醇在氧气中的燃烧反应 |
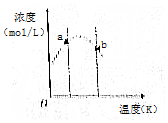 对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )| A. | 该反应的正反应是吸热反应 | B. | a处反应速率比b处反应速率大 | ||
| C. | 反应方程式中计量数x=1 | D. | b状态时:v(正)=v(逆) |