题目内容
18.实验室需要90mL 浓度为1mol•L-1的稀硫酸,现用18.0mol•L-1的浓硫酸配制,其操作可分为以下各步:A.用量筒量取5.6mL浓硫酸;
B.缓缓注入盛有少量蒸馏水的烧杯中,并用玻璃棒不断搅拌后,静置,待溶液冷却至室温;
C.用少量蒸馏水,洗涤烧杯和玻璃棒2-3 次,将每次洗液都倒入所选容量瓶里;
D.将稀释后稀硫酸小心倒入所选容量瓶里;
E.检查所选容量瓶是否会发生漏液;
F.将蒸馏水直接加入容量瓶,至液面距离刻度线1-2cm 处;
G.盖紧瓶塞,反复上下颠倒,摇匀溶液;
H.用胶头滴管向容量瓶里逐滴滴入蒸馏水,目光平视,滴至凹液面最低处与刻度线相平/相切.
(1)填写上述各步的空白处.
(2)正确的操作顺序是E→A→B→D→C→F→HG (填写字母).
(3)已经有的玻璃仪器包括玻璃棒,烧杯,10mL 量筒,还需要的玻璃仪器有胶头滴管,100mL 容量瓶.
分析 (1)A.需要90mL 浓度为1mol•L-1的稀硫酸,实际应选择100mL容量瓶,配制100mL溶液,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
B.容量瓶为精密仪器,移液前应将溶液冷却到室温;
H.依据容量瓶正确读数方法解答;
(2)依据配制一定物质的量浓度溶液的一般步骤排序;
(3)根据配制溶液的一般实验操作步骤确定每步操作需要仪器.
解答 解:(1)A.需要90mL 浓度为1mol•L-1的稀硫酸,实际应选择100mL容量瓶,配制100mL溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18.0mol/L=100mL×1mol/L,解得V=5.6mL;
故答案为:5.6;
B.容量瓶为精密仪器,移液前应将溶液冷却到室温,所以缓缓注入盛有少量蒸馏水的烧杯中,并用玻璃棒不断搅拌后,静置,待溶液冷却至室温;
故答案为:静置,待溶液冷却至室温;
H.定容时,用胶头滴管向容量瓶里逐滴滴入蒸馏水,目光平视,滴至凹液面最低处与刻度线相平/相切;
故答案为:凹液面最低处与刻度线相平/相切;
(2)实验室配制一定物质的量浓度溶液的一般步骤:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀等所以正确的操作顺序为:E→A→B→D→C→F→H→G;
故答案为:C→F→H;
(3)实验室配制一定物质的量浓度溶液的一般步骤:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀等,用到的仪器:10mL量筒、烧杯、玻璃棒、胶头滴管、容量瓶,需要90mL 浓度为1mol•L-1的稀硫酸,应选择100mL容量瓶,所以还需要的玻璃仪器有胶头滴管,100mL 容量瓶;
故答案为:胶头滴管,100mL 容量瓶.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格的选择,题目难度不大.

| A. | “膏液”的主要成分是石油 | B. | “膏液”是天然高分子化合物 | ||
| C. | “膏液”是烃的混合物 | D. | “膏液”能发生取代反应 |
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 1.58 | 158 |
| 硝酸银 | 0.02 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.1 mol/L.
(3)配制上述“鲜花保鲜剂”用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少500mL容量瓶,胶头滴管(填写所缺仪器的名称).
(4)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容,
正确的操作顺序是⑤①④⑥③⑦②(填序号).
(5)若定容时俯视容量瓶刻度线,会使所配溶液浓度偏大(填偏大、偏小、不变).
| A. | 物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 | |
| B. | 100mL1mol•L-1的盐酸和50mL2mol•L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 | |
| C. | 100mLpH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 | |
| D. | 100mLpH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.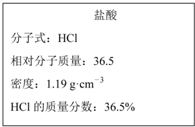 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: 室温下向10mL 0.1mol•L-1 NaOH溶液中逐滴加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.
室温下向10mL 0.1mol•L-1 NaOH溶液中逐滴加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.