题目内容
3. 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有500mL容量瓶(写仪器名称).
(2)该浓硫酸的物质的量浓度为18.4 mol/L;所需浓硫酸的体积约为27.2mL;
(3)定容时,若加入的水超过刻度线,必须采取的措施是重新配制
(4)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:偏低;
②容量瓶用水洗净后未烘干:无影响;
③定容时俯视容量瓶的刻度线:偏高;
④未将烧杯中的溶液冷却即注入容量瓶:偏高.
(5)在配置过程中,下列操作不正确的是(填序号)BC.
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将准确量取的浓硫酸,注入已盛有100mL水的500mL的容量瓶中,加水至刻度线.
D.将硫酸溶于水后需冷却至室温再转移到容量瓶中
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀.
分析 (1)根据实验操作的步骤(计算→量取→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签)以及每步操作需要仪器确定反应所需仪器和用不到的仪器,依据配制溶液体积选择需要容量瓶规格;
(2)根据c=$\frac{1000ρω}{M}$计算浓浓硫酸的物质的量浓度,依据稀释定律:C浓V浓=C稀V稀来计算需要浓硫酸体积;
(3)凡是错误操作引起实验失败且不能补救的,都必须重新配制;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)依据容量瓶构造及使用方法和注意事项解答.
解答 解:(1)溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用量筒量取,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以需要的仪器为:量筒、烧杯、玻璃棒、容量瓶、胶头滴管;480mL 1mol•L-1的稀硫酸,应选择500mL容量瓶;所以还缺少的仪器:500mL容量瓶;
故答案为:500mL容量瓶;
(2)根据c=$\frac{1000ρω}{M}$可知浓硫酸的浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;
设需要浓硫酸的体积为Vml,根据稀释定律C浓V浓=C稀V稀可知有:18.4mol/L×Vml×10-3=1mol/L×0.5L
解得:V=27.2ml,
故答案为:18.4;27.2;
(3)由于操作不慎,定容时使液面略超过了容量瓶的刻度(标线),溶液体积偏大,且无法补救,所以必须重新配制;
故答案为:重新配制;
(4)①转移溶液后,未洗涤烧杯,导致溶质的物质的量偏小,溶液浓度偏低;
故答案为:偏低;
②容量瓶用水洗净后未烘干,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,
故答案为:无影响;
③定容时俯视容量瓶的刻度线,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
④未将烧杯中的溶液冷却即注入容量瓶,冷却后溶液体积偏小,溶液浓度偏高,
故答案为:偏高;
(5)A.容量瓶带有瓶塞,使用过程中需要上下颠倒,所以使用前应检查是否漏水,故A正确;
B.容量瓶用蒸馏水洗净后,再用待配液润洗,导致溶质的物质的量偏大,溶液浓度偏高,故B错误;
C.容量瓶为精密仪器,不能用来稀释浓硫酸,浓硫酸稀释时应将浓硫酸沿着烧杯壁缓缓注入水中,故C错误;
D.容量瓶只有在标定的温度下其容积才准确,所以移液前需冷却至室温,故D正确;
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,故E正确;
故选:BC.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作方法是解题关键,注意容量瓶构造及使用方法和注意问题,为考试频考点,题目难度不大,注意对基础知识积累.

 名师金手指领衔课时系列答案
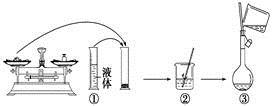
名师金手指领衔课时系列答案(1)选择仪器。完成本实验所必需的仪器有:托盘天平 药匙、烧杯、玻璃棒、____________、____________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体____________g。
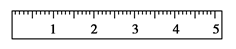
(3)称量。天平调平之后,应将天平的游码调至某个位置,请在下图中用一根 竖线标出游码左边缘所处的位置:
(4)将药品倒入烧杯中溶解、冷却。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次是为了_____________
(6)定容、摇匀。
(7)将配好的溶液倒入指定的试剂瓶,并贴好标签,注明溶液名称及浓度。
(8)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出 | B.容量瓶用蒸馏水洗净后未干燥 |
C.定容时俯视读取刻度 | D.定容时液面超过了刻度线 |
E.称量NaCl时用了生锈的砝码
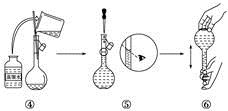
(9)下图是某同学在实验室配制该NaCl溶液的过程示意图,其中有错误的是_________(填操作序号)。
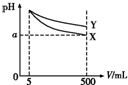 将5 mL pH=11的X、Y两种碱分别稀释至500 mL,其pH与溶液体积(V)的关系如图,下列说法正确的是( )
将5 mL pH=11的X、Y两种碱分别稀释至500 mL,其pH与溶液体积(V)的关系如图,下列说法正确的是( )| A. | 若X、Y都是弱碱,则a的值一定大于9 | |
| B. | 完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y) | |
| C. | 稀释后X溶液中水的电离程度比Y溶液中水的电离程度小 | |
| D. | 若X、Y是一元碱,则等物质的量浓度的Y的硝酸盐溶液的pH比X的硝酸盐溶液大 |
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: