题目内容
5.下列说法正确的是( )| A. | 物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 | |
| B. | 100mL1mol•L-1的盐酸和50mL2mol•L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 | |
| C. | 100mLpH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 | |
| D. | 100mLpH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
分析 不同的酸与锌反应时,反应速率与氢离子浓度成正比;锌足量时,生成氢气质量与酸的物质的量和元数成正比,据此分析解答.
解答 解:A.醋酸为弱酸,不能完全电离,HCl是强电解质,完全电离,等体积、等物质的量浓度的盐酸和醋酸,c(H+)不等,所以起始时反应的速率不等,故A错误;
B.100mL1mol•L-1的盐酸和50mL2mol•L-1的盐酸,酸的物质的量相等,但溶液中氢离子浓度不等,分别与足量的锌反应时,两者放出H2速率不等,但生成氢气质量相等,故B错误;
C.100 mLpH=3的H2SO4和HCl溶液,n(H+)相等,与足量锌反应后,放出H2的质量相等,故C正确;
D.100mLpH=3的盐酸与醋酸溶液,n(H+)不相等,与足量锌反应后,所得H2的质量不等,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断及知识综合应用能力,明确反应速率与氢离子浓度成正比、生成氢气总量与(金属质量相等且足量)酸的物质的量成正比是解本题关键,反应速率与酸的强弱无关,题目难度不大.

练习册系列答案
相关题目
16.(1)下列物质中,属于弱电解质的是(填序号,下同)⑦⑨,属于非电解质的是④⑥⑩.
①亚硫酸溶液 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡
⑥氨气 ⑦冰醋酸 ⑧硫酸氢钠固体 ⑨氢氧化铁 ⑩NO2
(2)写出下列物质在水中的电离方程式
亚硫酸:H2SO3?H++HSO3-;次氯酸钠:NaClO═ClO-+Na+;
(3)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲:c(OH-)乙小于10(填“大于”、“等于”或“小于”).
(4)下表数据均在相同温度下测得,由此可知三种酸的酸性由强到弱的顺序为HZ>HY>HX
(5)NO2与NO之间存在如下可逆反应:2NO2?2NO+O2.T℃时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是①③④⑤
①混合气体的颜色不再改变的状态 ②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态 ④混合气体的平均相对分子质量不再改变的状态
⑤$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$的比值不再改变的状态.
①亚硫酸溶液 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡
⑥氨气 ⑦冰醋酸 ⑧硫酸氢钠固体 ⑨氢氧化铁 ⑩NO2
(2)写出下列物质在水中的电离方程式
亚硫酸:H2SO3?H++HSO3-;次氯酸钠:NaClO═ClO-+Na+;
(3)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲:c(OH-)乙小于10(填“大于”、“等于”或“小于”).
(4)下表数据均在相同温度下测得,由此可知三种酸的酸性由强到弱的顺序为HZ>HY>HX
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
①混合气体的颜色不再改变的状态 ②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态 ④混合气体的平均相对分子质量不再改变的状态
⑤$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$的比值不再改变的状态.
13.25℃时,pH=3的盐酸a L分别与下列三种溶液充分混合后,溶液均呈中性:
①c(NH3•H2O)=1×10-3 mol•L-1的氨水b L,
②c(OH-)=1×10-3 mol•L-1的氨水c L,
③c(OH-)=1×10-3 mol•L-1的Ba(OH)2溶液d L.
试判断a、b、c、d的数量大小关系为( )
①c(NH3•H2O)=1×10-3 mol•L-1的氨水b L,
②c(OH-)=1×10-3 mol•L-1的氨水c L,
③c(OH-)=1×10-3 mol•L-1的Ba(OH)2溶液d L.
试判断a、b、c、d的数量大小关系为( )
| A. | a=b>c>d | B. | b>a=d>c | C. | b>a>d>c | D. | c>a=d>b |
14.在pH=1的无色透明溶液中,不能大量共存的离子组是( )
| A. | Al3+、Ag+、NO3-、I- | B. | Mg2+、NH4+、NO3-、Cl- | ||
| C. | NH4+、K+、S2-、Br- | D. | Zn2+、Na+、NO3-、SO42- |
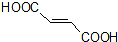 的合成路线如下:
的合成路线如下: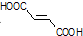
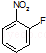 中含有的官能团名称为硝基,氟原子.
中含有的官能团名称为硝基,氟原子.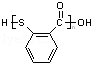 .
.