题目内容
下列各变化中属于原电池反应的是( )
①在空气中金属铝表面迅速氧化形成保护层
②镀锌铁表面有划损时,仍然能阻止铁被氧化
③红热的铁丝与冷水接触,表面形成蓝黑色保护层
④锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快.
①在空气中金属铝表面迅速氧化形成保护层
②镀锌铁表面有划损时,仍然能阻止铁被氧化
③红热的铁丝与冷水接触,表面形成蓝黑色保护层
④锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快.
| A、只有②④ | B、只有④ |
| C、只有②③④ | D、只有①②④ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:①Al被氧化为氧化铝;
②Zn比Fe活泼,构成原电池,Fe作正极;
③Fe与水发生化学反应;
④锌置换出铜,形成原电池反应.
②Zn比Fe活泼,构成原电池,Fe作正极;
③Fe与水发生化学反应;
④锌置换出铜,形成原电池反应.
解答:
解:①在空气中铝表面迅速氧化形成保护层是因Al被氧化为氧化铝,与电化学无关,故错误;
②Zn比Fe活泼,构成原电池,Fe作正极,所以Fe被保护,与电化学有关,故正确;
③Zn比Fe活泼,构成原电池,Fe作正极,所以Fe被保护,与电化学有关,故错误;
④锌置换出铜,形成原电池反应,进而加快反应速率,与电化学有关,故正确.
故选A.
②Zn比Fe活泼,构成原电池,Fe作正极,所以Fe被保护,与电化学有关,故正确;
③Zn比Fe活泼,构成原电池,Fe作正极,所以Fe被保护,与电化学有关,故错误;
④锌置换出铜,形成原电池反应,进而加快反应速率,与电化学有关,故正确.
故选A.
点评:本题考查化学反应及化学反应,明确电化学反应的构成条件是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、0.1mol?L-1 Na2S溶液中含有的Na+离子数为0.2NA |
| B、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| C、标准状况下,22.4L以任意比例混合的氢气和氯气混合气中含有的原子总数为2NA |
| D、0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
下列有关说法正确的是( )
| A、标准状况下,33.6L HF中含有氟原子的数目为1.5NA |
| B、1L 0.1mol/L的碳酸钠溶液中的阴离子总数等于0.1NA |
| C、30g SiO2中有0.5NA个[SiO4]四面体 |
| D、某密闭容器中盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2═3CO2+N2O.下列关于N2O的说法一定正确的是( )
| A、上述反应中,每消耗2mol NO2,就会生成22.4L N2O |
| B、CO2是氧化产物,且为H2CO3的酸酐 |
| C、等质量的N2O和CO2含有相等的电子数 |
| D、N2O会迅速与人体血红蛋白结合,使人中毒 |
XeF4在水中的反应为:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑.下列说法中正确的是( )
| A、XeF4分子中各原子均达到8电子稳定结构 |
| B、XeF4分子中Xe的化合价为0价 |
| C、上述反应中氧化剂和还原剂的物质的量之比为2:3 |
| D、XeF4按上述方式水解,每生成4mol Xe,转移16mol电子 |
化学实验是科学探究过程中的一神重要方法.下列有关实验的说法正确的是( )
| A、除去Cu2+(aq)中混有的少量Fe3+,可向其中通入过量的NH3 |
| B、在中和热测定的实验中,做三次平行实验最少要使用6次温度计 |
| C、FeCl3溶液与KSCN溶液混合,存在下述平衡:FeCl3+3KSCN?Fe(SCN)3+3KCl当达到平衡时,保持其他条件不变,可向其中加入固体KCl,来探究浓度对反应速率的影响 |
| D、常温下,用pH计测量等物质的量浓度的NaHC03和NaHS03溶液的pH,来探究H2CO3、H2SO3酸性的相对强弱 |
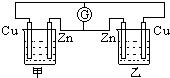 在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )
在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )| A、电流计G的指针不动 |
| B、通过电流计G的电子流动方向是由下向上 |
| C、甲、乙两装置都不是电解槽 |
| D、甲装置中铜极上有气泡产生,乙装置中,[H+]会减小 |
氨甲环酸和氨甲苯酸是临床上常用的止血药,其结构如图所示:
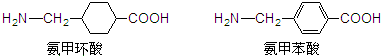
下列说法错误的是( )
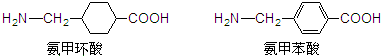
下列说法错误的是( )
| A、氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液 |
| B、氨甲苯酸属于芳香族α-氨基酸的同分异构体和苯丙氨酸互为同系物 |
| C、氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚、加成等反应 |
| D、氨甲环酸、氨甲苯酸中各有5种不同的氢原子 |



