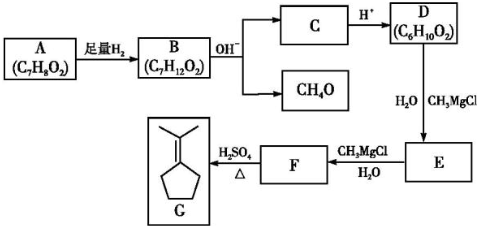
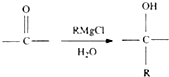
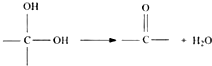
题目内容
对于以下反应:改变反应物用量时,不能用同一个离子方程式表示的是( )
①KHCO3溶液与石灰水反应
②Na2SO3溶液与稀盐酸反应
③Si与烧碱溶液反应
④Fe与稀硝酸反应.
①KHCO3溶液与石灰水反应
②Na2SO3溶液与稀盐酸反应
③Si与烧碱溶液反应
④Fe与稀硝酸反应.
| A、①②③ | B、①②④ |
| C、①③④ | D、②③④ |
考点:离子方程式的书写
专题:离子反应专题
分析:在溶液中的反应,若反应产物与反应物的量无关时,只发生一个化学反应,反应物相同,生成物也相同,则就能用同一离子方程式表示,若反应产物与反应物的量有关时,不能用同一个离子方程式表示,以此来解答.
解答:
解:①:①KHCO3少量时,发生反应:KHCO3+Ca(OH)2═CaCO3↓+H2O+KOH;KHCO3过量时发生反应:2KHCO3+Ca(OH)2═CaCO3↓+2H2O+K2CO3,所以不能用同一离子方程式表示,故①正确;
②Na2SO3溶液与稀盐酸反应,盐酸量少,离子反应为:SO32-+H+═HSO3-;而盐酸量多时,离子反应为SO32-+2H+═H2O+SO2↑,所以不能用同一个离子方程式来表示,故②正确;
③Si与烧碱溶液反应生成硅酸钠和氢气,与反应物用量无关,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,可以用同一离子方程式表示,故③错误;
④Fe与稀硝酸反应,Fe不足生成Fe3+,离子方程式为:4H++NO3-+Fe═Fe3++NO↑+2H2O;Fe过量生成Fe2+,离子方程式为:8H++2NO3-+3Fe═3Fe2++2NO↑+4H2O,所以不能用同一个离子方程式来表示,故④正确;
故选:B.
②Na2SO3溶液与稀盐酸反应,盐酸量少,离子反应为:SO32-+H+═HSO3-;而盐酸量多时,离子反应为SO32-+2H+═H2O+SO2↑,所以不能用同一个离子方程式来表示,故②正确;
③Si与烧碱溶液反应生成硅酸钠和氢气,与反应物用量无关,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,可以用同一离子方程式表示,故③错误;
④Fe与稀硝酸反应,Fe不足生成Fe3+,离子方程式为:4H++NO3-+Fe═Fe3++NO↑+2H2O;Fe过量生成Fe2+,离子方程式为:8H++2NO3-+3Fe═3Fe2++2NO↑+4H2O,所以不能用同一个离子方程式来表示,故④正确;
故选:B.
点评:本题考查了离子方程式的书写,侧重考查反应物用量对反应的影响,熟悉反应的实质是解题关键,题目难度中等.

练习册系列答案
相关题目
在恒温恒容条件下,能使A(g)+2B(s)?C(g)+3D(g)的正反应速率增大的措施是( )
| A、减小C的浓度 |
| B、增大B的量 |
| C、减小D的浓度 |
| D、增大A的量 |
已知Kφ(AgCl)=1.8×10-10mol2?L-2,Kφ(AgBr)=5.0×10-13mol2?L-2,Kφ(Ag2CrO4)=9.0×10-12mol2?L-3.某溶液中含有Cl-、Br-和CrO42-,浓度均为0.10mol?L-1,向该溶液中逐滴加入0.10mol?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A、Cl-、Br-、CrO42- |
| B、CrO42-、Br-、Cl- |
| C、Br-、Cl-、CrO42- |
| D、Br-、CrO42-、Cl- |
在蒸馏实验中,下列叙述不正确的是( )
A、在蒸馏烧瓶中盛约
| ||
| B、收集蒸馏水时,应弃去开始馏出的部分 | ||
| C、冷水从冷凝管下口入,上口出 | ||
| D、将温度计水银球插入自来水中 |
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是( )
| A、氯气:K+、Ba2+、SiO32-、NO3- |
| B、二氧化硫:Na+、NH4+、SO32-、C1- |
| C、氨气:K+、Na+、AlO2-、CO32- |
| D、甲醛:Ca2+、Mg2+、MnO4-、NO3- |
已知下列氧化还原反应:2BrO3-+Cl2═Br2+2ClO3-,5Cl2+I2+6H2O═2IO3-+10Cl-+12H+,ClO3-+5Cl-+6H+═3Cl2↑+3H2O.上述条件下,各微粒氧化性由强到弱的排列顺序正确的是( )
| A、ClO3->BrO3->IO3->Cl2 |
| B、BrO3->Cl2>ClO3->IO3- |
| C、BrO3->ClO3->Cl2>IO3- |
| D、Cl2>BrO3->ClO3->IO3- |