题目内容
2.U、W、Y是原子序数依次增大的短周期主族元素,在周期表中的相对位置如右表;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.| U | |||
| W | Y |
(2)能提高W与稀硫酸反应速率的方法是bd
a.使用浓硫酸 b.加热 c.加压 d.使用等质量的W粉末
(3)在恒容密闭容器中进行:2YO2(g)+O2(g)$?_{催化剂}^{450℃}$ 2YO3(g)△H2=-190kJ/mol
①该反应 450℃时的平衡常数> 500℃时的平衡常数(填<,>或=).
②下列描述中能说明上述反应已达平衡的是abd
a.2ν(O2)正=ν(YO3)逆 b.气体的平均分子量不随时间而变化
c.反应时气体的密度不随时间而变化 d.反应时气体的分子总数不随时间而变化
③在一个固定容积为2L的密闭容器中充入0.20mol YO2和0.10molO2,半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=0.09mol/(L.min):平衡常数为16200.若继续通入0.20molYO2和0.10molO2,再次达到平衡后,YO3物质的量约为0.368mol.
分析 U、W、Y是原子序数依次增大的短周期主族元素,W是地壳中含量最多的金属元素,W是Al元素;根据元素在周期表中的位置可知U为C元素、Y为S元素.
(1)元素U为碳,原子核外电子排布式为1s22s22p2;
(2)升高温度、增大反应物接触面积,可以加快反应速率,对有气体参加的反应,增大压强可以提高反应速率,本题中适当增大氢离子浓度可以加快反应速率,但Al在浓硫酸中会发生钝化现象;
(3)①正反应放热反应,升高温度平衡逆向移动,平衡常数减小;
②可逆反应到达平衡时,同种物质的正、逆反应速率相等(不同种物质的正、逆速率之比等于其化学计量数之比),各组分的含量保持不变,物理量随反应进行由变化到不变,说明到达平衡;
③利用三段式计算平衡时各组分物质的量、各组分变化量,再根据v=$\frac{△c}{△t}$计算ν(O2),根据K=$\frac{{c}^{2}(Y{O}_{3})}{{c}^{2}(Y{O}_{2})×v({O}_{2})}$计算平衡常数.
等效为开始加入0.40molYO2和0.20molO2,结合平衡常数计算.
解答 解:U、W、Y是原子序数依次增大的短周期主族元素,W是地壳中含量最多的金属元素,W是Al元素;根据元素在周期表中的位置可知U为C元素、Y为S元素.
(1)元素U为碳,原子核外电子排布式为1s22s22p2,其原子核外共有1s、2s、2p三种能级电子,
故答案为:3;
(2)a.Al在浓硫酸中会发生钝化现象,使用浓硫酸不能加快反应速率,故a错误;
b.升高温度,可以加快反应速率,故b正确;
c.没有气体参加反应,加压不能加快反应速率,故c错误;
d.使用等质量的W粉末,增大接触面积,可以加快反应速率,故d正确,
故选:bd;
(3)①正反应放热反应,升高温度平衡逆向移动,平衡常数减小,即450℃时的平衡常数大于500℃时的平衡常数,
故答案为:>;
②a.2ν(O2)正=ν(YO3)逆时,说明YO3正、逆反应速率相等,反应达到平衡状态,故a正确;
b.反应为气体物质的量减小的反应,而气体质量不变,随反应进行平均分子量增大,容器中气体的平均分子量不随时间而变化说明反应达到平衡状态,故b正确;
c.气体总质量不变,恒容密闭容器中气体的密度始终不变,故c错误;
d.反应为气体物质的量减小的反应,容器中气体的分子总数不随时间而变化说明反应达到平衡状态,故d正确,
故选:abd;
③半分钟后达到平衡,测得容器中含YO30.18mol,则:
2YO2(g)+O2(g)?2YO3(g)
起始(mol):0.2 0.1 0
变化(mol):0.18 0.09 0.18
平衡(mol):0.02 0.01 0.18
故ν(O2)=$\frac{\frac{0.09mol}{2L}}{0.5min}$=0.09mol/(L.min),
平衡常数K=$\frac{{c}^{2}(Y{O}_{3})}{{c}^{2}(Y{O}_{2})×v({O}_{2})}$=$\frac{(\frac{0.18}{2})^{2}}{(\frac{0.02}{2})^{2}×\frac{0.01}{2}}$=16200,
等效为开始加入0.40molYO2和0.20molO2,设平衡时YO3物质的量为x,则:
2YO2(g)+O2(g)?2YO3(g)
起始(mol):0.4 0.2 0
变化(mol):x 0.5x x
平衡(mol):0.4-x 0.2-0.5x x
所以$\frac{(\frac{x}{2})^{2}}{(\frac{0.4-x}{2})^{2}×\frac{0.2-0.5x}{2}}$=16200,
解得x≈0.368
故答案为:0.09mol/(L.min);16200;0.368mol.
点评 本题以元素推断为载体,考查核外电子排布、化学反应速率影响因素、平衡常数、化学平衡状态判断、化学平衡有关计算等,(3)中计算量大,为易错点,平衡状态判断中变化量不再变化时说明到达平衡.

 星级口算天天练系列答案
星级口算天天练系列答案| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.4}{{t}_{1}}$mol.L-1.min-1 | |
| B. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| C. | 保持其他条件不变,若向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO和H2O的转化率均增大 | |
| D. | 保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20 mol H2O,则到达平衡时,n(CO2)=0.40 mol |
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为226.3kJ.
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.
实验结果如图1所示:(图中T表示温度,n表示物质的量)
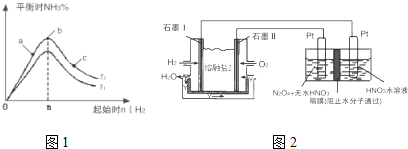
①图象中T2和T1的关系是:T2低于T1(填“高于”、“低于”、“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c(填字母).
③在起始体系中加入N2的物质的量为$\frac{n}{3}$mol时,反应后氨的百分含量最大; 若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=2.08.
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)?4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
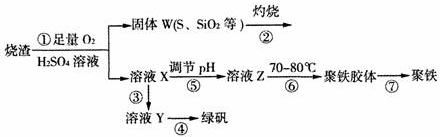
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2.
写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
| 温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8 mol3•L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A. | 若Z的体积分数不再随时间变化时表示反应达平衡状态 | |
| B. | 35 oC时,达平衡时,X分解了 0.03 mol | |
| C. | 该反应在高温下可能自发 | |
| D. | 若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大 |
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是(填字母)ac.
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.若容器内压强恒定时,标志反应达到平衡状态
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO2的转化率.
| A. | 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸 | |
| B. | 制蒸馏水时,应使温度计水银球雄近蒸馆烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上 |
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.