题目内容
3.关于氯化镁溶液和氢氧化铁胶体的说法中正确的是( )| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 两者的分散质微粒均能透过半透膜和滤纸 | |
| C. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的“光亮的通路”,前者则没有 |
分析 溶液、胶体都为分散系,呈电中性,胶体具有丁达尔效应,不能透过半透膜,可发生电泳,以此解答该题.
解答 解:A.胶体呈电中性,胶粒可带电,故A错误;
B.胶体粒子不能透过半透膜,故B错误;
C.溶液、胶体粒子的运用都没有规律,故C错误;
D.胶体粒子直径介于1-100nm之间,具有丁达尔效应,故D正确.
故选D.
点评 本题考查溶液与胶体的性质,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关知识的积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按如表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为60%.
②下列说法正确的是(填字母)ac.
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.若容器内压强恒定时,标志反应达到平衡状态
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO2的转化率.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是(填字母)ac.
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.若容器内压强恒定时,标志反应达到平衡状态
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO2的转化率.
18.污染大气并形成酸雨的主要物质是( )
| A. | CO | B. | NH3 | C. | SO2 | D. | HCl |
8.下列说法中不正确的是( )
| A. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| C. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| D. | 二氯甲烷存在两种不同的结构 |
15.我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程如图:下列有关说法中不正确的是( )


| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应 | |
| C. | 1molM与热的烧碱溶液反应,可消耗2nmol的NaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
12.下列实验操作中错误的是( )
| A. | 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸 | |
| B. | 制蒸馏水时,应使温度计水银球雄近蒸馆烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上 |
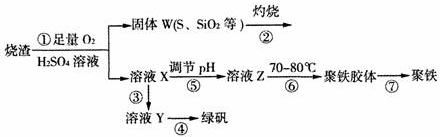
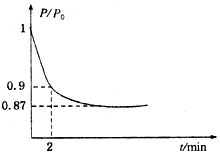 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.