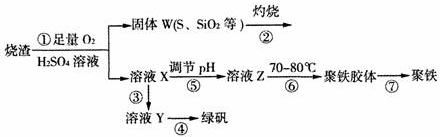
题目内容
18.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: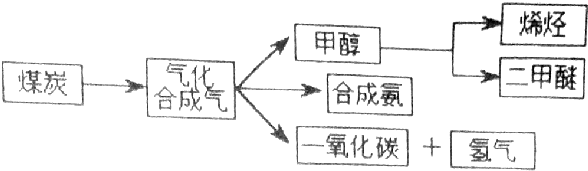
Ⅰ.已知该产业链中某反应的平衡表达式为:K=$\frac{C({H}_{2})•C(CO)}{C({H}_{2}O)}$,它所对应反应的化学方程式C(s)+H2O(g)?CO(g)+H2(g)(要注明物质的状态).
II、二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0MPa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=一90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=一23.5kJ•mol-1
③CO(g)+2H2O(g)?CO3(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1.830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为,c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,则5min 内CO的平均反应速率为0.1mol/(L•min);若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=amol/L,达到平衡后,c(CH3OH)=2mol/L,a=5.4mol/L.
分析 I.根据平衡常数表达式可写成化学方程式;
Ⅱ.(1)运用盖斯定律按照目标方程式将已知的热化学方程式变形运算得到所要求得目标反应的热化学方程式;反应③为放热反应降低温度平衡正向移动K值增大;
(2)列三段表示出反应达到平衡过程中各物质的浓度,运用反应速率表达式求出5min内CO的平均反应速率,应用K求出a值.
解答 解:Ⅰ.因为K=$\frac{C({H}_{2})•C(CO)}{C({H}_{2}O)}$,所以该反应的方程式为:C(s)+H2O(g)?CO(g)+H2(g),注意C为固态,不列入平衡常数表达式,
故答案为:C(s)+H2O(g)?CO(g)+H2(g);
Ⅱ.(1)①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
依据盖斯定律将方程式变形①×2+②+③得 3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g),△H=△H1×2+△H2+△H3=-246.1kJ•mol-1
反应③为放热反应降低温度平衡正向移动K值增大,830℃时反应③的K=1.0,催化反应室中温度为230~280℃,所以K值增大,K>1.0;
故答案为:3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1;>;
(2)CO(g)+2H2(g)?CH3OH(g)
起始浓度( mol/L) 1 2.4 0
转化浓度( mol/L) 0.5 1 0.5
平衡浓度( mol/L) 0.5 1.4 0.5
△C(CO)=1×0.5=0.5
V(CO)=△C(CO)÷t=0.5mol/L÷5min=0.1mol/(L•min);
K=$\frac{[CH{\;}_{3}OH]}{[CO][H{\;}_{2}]{\;}^{2}}$=$\frac{0.5}{0.5×1.4{\;}^{2}}$=$\frac{1}{1.4{\;}^{2}}$
CO(g)+2H2(g)?CH3OH(g)
起始浓度( mol/L) 4 a 0
转化浓度( mol/L) 2 4 2
平衡浓度( mol/L) 2 a-4 2
因为温度相同所以改变初始浓度后平衡常数不变K=$\frac{2}{2×(a-4){\;}^{2}}$=$\frac{1}{1.4{\;}^{2}}$
a=5.4mol/L;
故答案为:0.1mol/(L•min); 5.4.
点评 本题考查了盖斯定律求反应热、化学平衡常数表达式及其应用,难度中等,注意平衡常数的应用.

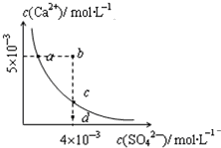 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )| A. | CaSO4溶解在水中,c(Ca2+)=c(SO42-)=3×10-3mol/L | |
| B. | 在d点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| C. | a点对应的Ksp等于c点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)等于3×10-3mol/L |
| A. | 达到化学平衡时,正反应速率与逆反应速率不相等 | |
| B. | 反应过程中,Y的单质的体积分数始终为50% | |
| C. | 达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1 | |
| D. | 达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小 |
 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.(1)已知:①2CH4(g)+3O2(g)?2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+H2O(g)?CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是CD.
A.v(CH4)正=3v(H2)逆
B.水蒸气的浓度与一氧化碳的浓度相等
C.平均相对分子质量不随时间的变化而变化
D.密度不随时间的变化而变化
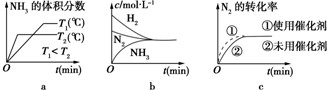
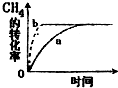
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是增加了催化剂.
(3)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | D | t |
②实验2中的平衡常数是0.17(计算结果保留两位小数).
③该反应的△H<0(填“>”或“<”).
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a或a:b=1:2(用含a、b的式子表示).
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为226.3kJ.
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.
实验结果如图1所示:(图中T表示温度,n表示物质的量)
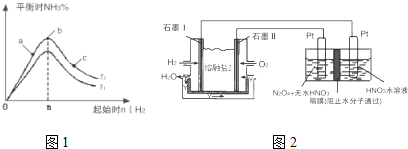
①图象中T2和T1的关系是:T2低于T1(填“高于”、“低于”、“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c(填字母).
③在起始体系中加入N2的物质的量为$\frac{n}{3}$mol时,反应后氨的百分含量最大; 若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=2.08.
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)?4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2.
写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
| 温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8 mol3•L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A. | 若Z的体积分数不再随时间变化时表示反应达平衡状态 | |
| B. | 35 oC时,达平衡时,X分解了 0.03 mol | |
| C. | 该反应在高温下可能自发 | |
| D. | 若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大 |
| A. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| C. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| D. | 二氯甲烷存在两种不同的结构 |