题目内容
17. 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.(1)汽车内燃机工作时发生反应:N2(g)+O2(g)2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.
①5min内该反应的平均速率υ (NO)=0.2mol/(L•min);在T℃时,该反应的平衡常数
K=1.25.
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是cd(填序号).
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol.
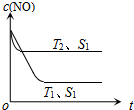
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H<0(填“>”或“<”).
②若催化剂的表面积S1>S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线.
分析 (1)①利用三段法“开始 变化 平衡”列出各组分数据,代入化学反应速率和化学平衡常数表达式计算;
②a.混合气体的总质量不变,容器的体积不变,据此判断;
b.混合气体总的物质的量不变,容器体积不变,据此判断;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,故单位时间内,N2的消耗量减小,NO的消耗量增大;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的计算;
(3)①根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图.
解答 解:(1)①T℃时,向 5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol,
由题中所给数据可知:
N2(g)+O2(g)?2NO(g)
起始浓度(mol•L-1)1.3 1.5 0
转化浓度(mol•L-1)0.5 0.5 1.0
平衡浓度(mol•L-1)0.8 1.0 1.0
则υ(NO)=$\frac{1.0mol/L}{5min}$=0.2mol/(L•min),K=$\frac{{c}^{2}(NO)}{c({N}_{2})c({O}_{2})}$=$\frac{{1}^{2}}{0.8×1.0}$=1.25,
故答案为:0.2mol/(L•min);1.25;
②a.混合气体的总质量不变,容器的体积不变,混合气体的密度不变,故a不符合;
b.混合气体总的物质的量不变,容器体积不变,混合气体的压强不变,故b不符合;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低,故c符合;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,故单位时间内,N2的消耗量减小,NO的消耗量增大,单位时间内,N2和NO的消耗量之比减小,故d符合;
故答案为:cd;
(2)①已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1
依据盖斯定律可知②-①得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H,
△H=(-571.6kJ/mol)-180.5kJ/mol═-752.1kJ/mol;由于正反应放热(△H<0),且正反应方向气体体积减小,为熵减小的方向,即△S<0,△H-T•△S<0,反应自发进行,所以T较小才可以,即低温下自发,
故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;
(3)①温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,故答案为:<;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为 ,故答案为:
,故答案为: .
.
点评 本题主要考查化学反应速率、影响化学平衡的因素、化学平衡图象以及热化学方程式的书写等,(3)中注意根据“先拐先平数值大”原则判断温度高低是关键,作图时注意到达平衡的时间与平衡时NO的浓度,难度不大.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | NO2起催化剂作用 | B. | NO起催化剂作用 | ||
| C. | NO2只起氧化剂作用 | D. | O3与O2为同位素 |
| A. | CH3COOH | B. | C2H5OH | C. | H2O | D. | HCl |
| A. | A、B、C、D、E | B. | B、A、E、D、C | C. | B、A、D、C、E | D. | C、D、A、B、E |
| A. | 反应中SiO2是氧化剂,C只作还原剂 | |
| B. | Si4+被还原了,而C只被氧化了 | |
| C. | 在反应中C既是氧化剂又是还原剂 | |
| D. | 在反应中氧化剂与还原剂的物质的量之比为2:1 |
| A. | C、D、E的单质均可以用电解法制取 | |
| B. | 一定条件下,元素B、D的最高价氧化物对应的水化物之间能发生反应 | |
| C. | C、D、E的原子半径:C>D>E | |
| D. | D与E形成的化合物属于共价化合物 |
| A. | 1mol水蒸气 | |
| B. | 标准状况下的46g乙醇 | |
| C. | 标准状况下所含原子数为1.806×1024的二氧化碳 | |
| D. | 0℃、2×105Pa时的2g氢气 |