题目内容
8.下列物质中最难电离出H+的是( )| A. | CH3COOH | B. | C2H5OH | C. | H2O | D. | HCl |
分析 根据酸性越强电离生成H+越容易,则最难电离出H+的是酸性最弱的物质或非电解质.
解答 解:A.CH3COOH是一种弱酸,CH3COOH?CH3COO-+H+在水溶液中能电离出H+;
B.C2H5OH属于非电解质,在水中不电离,则不会电离出H+;
C.水属于极弱电解质,能微弱电离生成H+;
D.HCl是强电解质,水溶液中完全电离;
四种物质的酸性关系为HCl>CH3COOH>H2O>C2H5OH,即最难电离出H+的是C2H5OH,
故选B.
点评 本题考查了电解质电离程度比较,注重对学生基础知识的考查,明确酸性强弱与电离生成H+的关系是解答本题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.x、y为两种短周期元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子半径大于y的原子半径 | |
| B. | x的电负性大于y的电负性 | |
| C. | x阴离子的半径小于y阳离子的半径 | |
| D. | x的第一电离能大于y 的第一电离能 |
19.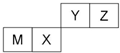 四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
 四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )| A. | 离子半径Z<M<X | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的强 | |
| C. | X 的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
16.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
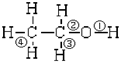

| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和④断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
3.蘸有浓硫酸的纸片会发黑,主要是浓硫酸具有( )
| A. | 吸水性 | B. | 氧化性 | C. | 脱水性 | D. | 酸性 |
13.下列各组物质,前者是纯净物,后者是混合物的是( )
| A. | 玻璃、绿矾 | B. | 液氨、汽油 | ||
| C. | 干冰、含镁60%的氧化镁 | D. | 植物油、空气 |
20.下列物质中,只含有非极性共价键的是( )
| A. | Na2O2 | B. | I2 | C. | CaCl2 | D. | NaOH |
18.在t℃时,NaOH的溶解度为20g,该温度下将50gNaOH放入220g水中充分搅拌后,测得溶液密度为1.2g/mL,则溶液的物质的量浓度为( )
| A. | 0.02mol/L | B. | 0.5mol/L | C. | 5mol/L | D. | 5.6 mol/L |
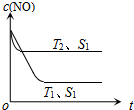 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.