题目内容
7.下列物质的体积约为22.4L的是( )| A. | 1mol水蒸气 | |
| B. | 标准状况下的46g乙醇 | |
| C. | 标准状况下所含原子数为1.806×1024的二氧化碳 | |
| D. | 0℃、2×105Pa时的2g氢气 |
分析 A.没有指出条件,且标准状况下水不是气体;
B.标准状况下,乙醇的状态不是气态;
C.根据n=$\frac{N}{{N}_{A}}$计算出二氧化碳的物质的量,然后根据V=nVm计算;
D.2g氢气的物质的量为1mol,0℃、2×105Pa时不是标准状况下.
解答 解:A.没有指出温度和压强,无法判断1mol水蒸气的体积,故A错误;
B.46g乙醇的物质的量为1mol,标准状况下乙醇不是气体,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.含原子数为1.806×1024的二氧化碳的物质的量为:$\frac{\frac{1.806×1{0}^{24}}{6.02×1{0}^{23}}}{3}$=1mol,标准状况下1mol二氧化碳的体积约为22.4L,故C正确;
D.2g氢气的物质的量为:$\frac{2g}{2g/mol}$=1mol,由于0℃、2×105Pa时的压强大于标准状况下的,则该条件下1mol氢气的体积小于22.4L,故D错误;
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与摩尔质量、阿伏伽德罗常数、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.在t℃时,NaOH的溶解度为20g,该温度下将50gNaOH放入220g水中充分搅拌后,测得溶液密度为1.2g/mL,则溶液的物质的量浓度为( )
| A. | 0.02mol/L | B. | 0.5mol/L | C. | 5mol/L | D. | 5.6 mol/L |
15.有关金属性质的叙述正确的是( )
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 都能导电、传热 | D. | 都只能和酸不能和碱发生化学反应 |
7.下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )
| A. | CH3CH2CH3 | B. | C2H6 | C. | CH3CH2OH | D. | CH3OCH3 |
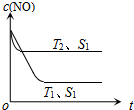 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务. 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):
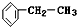 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$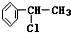 +HCl;②
+HCl;②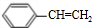 +NaCl+H2O;
+NaCl+H2O;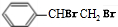 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$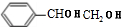 +2NaBr;⑤2
+2NaBr;⑤2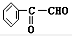 +2H2O;
+2H2O;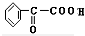 +H2$→_{△}^{Ni}$2
+H2$→_{△}^{Ni}$2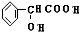 ;⑧n
;⑧n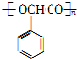 +nH2O.
+nH2O.