题目内容
6.已知B、C、D、E是短周期中原子序数依次增大的4种主族元素,其中元素E的单质常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.不正确的是( )| A. | C、D、E的单质均可以用电解法制取 | |
| B. | 一定条件下,元素B、D的最高价氧化物对应的水化物之间能发生反应 | |
| C. | C、D、E的原子半径:C>D>E | |
| D. | D与E形成的化合物属于共价化合物 |
分析 B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;元素E的单质在常温下呈气态,且E的原子序数大于Al,故E为Cl;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Al,故B原子只能有2个电子层,最外层电子数为4,则B为碳元素;元素C在同周期的主族元素中原子半径最大,结合原子序数可知,C只能处于第三周期,则C为Na,据此进行解答.
解答 解:B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;元素E的单质在常温下呈气态,且E的原子序数大于Al,故E为Cl;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Al,故B原子只能有2个电子层,最外层电子数为4,则B为碳元素;元素C在同周期的主族元素中原子半径最大,结合原子序数可知,C只能处于第三周期,则C为Na,
A.因为Na、Al是活泼金属,氯气是活泼的非金属单质,所以工业上常用电解法制备,故A正确;
B.元素B、D的最高价氧化物对应的水化物分别为碳酸、氢氧化铝,二者不发生反应,故B错误;
C.,同周期随原子序数增大原子半径减小,故原子半径Cl<Al<Na,即C>D>E,故C正确;
D.D、E分别为Al、Cl元素,二者形成的化合物氯化铝属于共价化合物,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,推断元素为解答关键,注意熟练掌握元素周期律内容、元素周期表结构,试题有利于提高学生的分析、理解能力及灵活应用能力.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
16.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
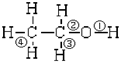

| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和④断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
14.如图所示,如果电流计偏转,a变粗,b变细,符合这种情况的是( )


| A. | a是锌,b是铜,c是硫酸溶液 | B. | a是铁,b是银,c是硝酸银溶液 | ||
| C. | a是银,b是铁,c是硝酸银溶液 | D. | a是铁,b是碳,c是氯化铜溶液 |
1.已知A、B、C、D、E是5种短周期元素,C、D、E是原子序数依次递增的同周期元素,A的最外层电子数是其电子层数的3倍,B是组成有机物的必要元素,元素D与B为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 简单离子半径:E>A>C | |
| B. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| C. | C与A形成的两种化合物中化学键类型完全相同 | |
| D. | B、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
11.同温度同浓度的下列四种溶液①NaF ②CH3COONa ③NaHCO3 ④NaHS,其pH大小顺序正确的是(已知酸性:HF>CH3COOH>H2CO3>H2S)( )
| A. | ①>②>③>④ | B. | ④>③>②>① | C. | ④>③>①>② | D. | ①>④>③>② |
18.在t℃时,NaOH的溶解度为20g,该温度下将50gNaOH放入220g水中充分搅拌后,测得溶液密度为1.2g/mL,则溶液的物质的量浓度为( )
| A. | 0.02mol/L | B. | 0.5mol/L | C. | 5mol/L | D. | 5.6 mol/L |
15.有关金属性质的叙述正确的是( )
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 都能导电、传热 | D. | 都只能和酸不能和碱发生化学反应 |
 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.