题目内容
9.对反应方程式:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,有关叙述正确的是( )| A. | 反应中SiO2是氧化剂,C只作还原剂 | |
| B. | Si4+被还原了,而C只被氧化了 | |
| C. | 在反应中C既是氧化剂又是还原剂 | |
| D. | 在反应中氧化剂与还原剂的物质的量之比为2:1 |
分析 SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价,以此来解答.
解答 解:A.只有C元素的化合价变化,则C为氧化剂、还原剂,故A错误;
B.该反应中C被氧化,也被还原,故B错误;
C.C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价,可知C既是氧化剂又是还原剂,故C正确;
D.1molC得到电子与2molC失去电子相同,则氧化剂与还原剂的物质的量之比为1:2,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意Si元素的化合价不变,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
19.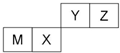 四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
 四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )| A. | 离子半径Z<M<X | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的强 | |
| C. | X 的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
20.下列物质中,只含有非极性共价键的是( )
| A. | Na2O2 | B. | I2 | C. | CaCl2 | D. | NaOH |
4.一块表面已被氧化为Na2O的钠块10.8g,将其投入100g水中,产生H2 0.2g,则被氧化的钠是( )
| A. | 9.2 g | B. | 10.6 g | C. | 6.2 g | D. | 4.6 g |
14.如图所示,如果电流计偏转,a变粗,b变细,符合这种情况的是( )


| A. | a是锌,b是铜,c是硫酸溶液 | B. | a是铁,b是银,c是硝酸银溶液 | ||
| C. | a是银,b是铁,c是硝酸银溶液 | D. | a是铁,b是碳,c是氯化铜溶液 |
1.已知A、B、C、D、E是5种短周期元素,C、D、E是原子序数依次递增的同周期元素,A的最外层电子数是其电子层数的3倍,B是组成有机物的必要元素,元素D与B为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 简单离子半径:E>A>C | |
| B. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| C. | C与A形成的两种化合物中化学键类型完全相同 | |
| D. | B、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
18.在t℃时,NaOH的溶解度为20g,该温度下将50gNaOH放入220g水中充分搅拌后,测得溶液密度为1.2g/mL,则溶液的物质的量浓度为( )
| A. | 0.02mol/L | B. | 0.5mol/L | C. | 5mol/L | D. | 5.6 mol/L |
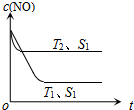 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
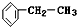 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$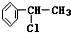 +HCl;②
+HCl;②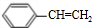 +NaCl+H2O;
+NaCl+H2O;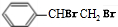 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$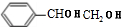 +2NaBr;⑤2
+2NaBr;⑤2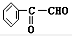 +2H2O;
+2H2O;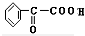 +H2$→_{△}^{Ni}$2
+H2$→_{△}^{Ni}$2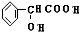 ;⑧n
;⑧n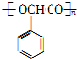 +nH2O.
+nH2O.