题目内容
9.A、B、C、D为4种钠的化合物,A、B、C和盐酸反应均得到D,将固体C加热可制得A,若在A的溶液中通入一种无色、无味气体,又可制得C,若B与C的溶液混合可制得A,试推断:(1)A是Na2CO3,B是NaOH,C是NaHCO3,D是NaCl.
(2)完成有关反应方程式:A→CNa2CO3+CO2+H2O═2NaHCO3;B+C→ANaOH+NaHCO3═Na2CO3+H2O.
分析 A、B、C、D为4种钠的化合物,由将固体C加热可制得A,若在A的溶液中通入一种无色、无味气体,又可制得C,可知C为NaHCO3,气体为二氧化碳,A为Na2CO3,A、C与盐酸反应均生成D为NaCl;由B与盐酸反应生成NaCl,B与C的溶液混合可制得A,可知B为NaOH,以此来解答.
解答 解:A、B、C、D为4种钠的化合物,由将固体C加热可制得A,若在A的溶液中通入一种无色、无味气体,又可制得C,可知C为NaHCO3,气体为二氧化碳,A为Na2CO3,A、C与盐酸反应均生成D为NaCl;由B与盐酸反应生成NaCl,B与C的溶液混合可制得A,可知B为NaOH,
(1)由上述分析可知,A、B、C、D分别为Na2CO3、NaOH、NaHCO3、NaCl,
故答案为:Na2CO3;NaOH;NaHCO3;NaCl;
(2)A→C的反应为Na2CO3+CO2+H2O═2NaHCO3,B+C→A的反应为NaOH+NaHCO3═Na2CO3+H2O,
故答案为:Na2CO3+CO2+H2O═2NaHCO3;NaOH+NaHCO3═Na2CO3+H2O.
点评 本题考查无机物的推断,为高频考点,把握发生的离子反应、钠的化合物的转化为解答的关键,侧重分析与推断能力的考查,注意C加热分解为推断的突破口,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.已知单质A、B和化合物C符合下列转化关系:A+B$\stackrel{点燃}{→}$C$\stackrel{溶于水后电解(惰性气体)}{→}$A+B,则C物质可能为( )
| A. | HCl | B. | Na2O2 | C. | CuO | D. | FeCl3 |
3.某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取纯铜和绿矾(FeSO4•7H2O)产品,设计流程如图1:
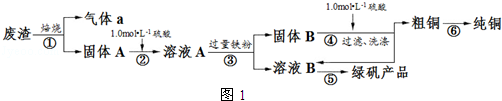
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外、胶头滴管,还有500mL容量瓶.
(2)该小组同学设计如图2装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.
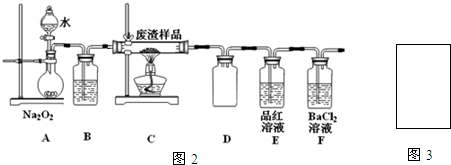
①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;D装置作用安全瓶,E装置中的现象是品红溶液红色褪去
②当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+
③反应装置不完善,为避免空气污染,在图3方框中补全装置图,并注明试剂名称.
(3)从图4选择合适的装置,写出步骤⑤中进行的操作顺序cb(填序号)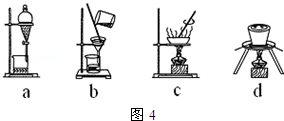
(4)步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(5)为测定产品中绿矾的质量分数,称取30.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如表所示:
①第1组实验数据出现异常,造成这种异常的原因可能是c(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定前尖嘴有气泡,滴定后气泡消失
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.

(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外、胶头滴管,还有500mL容量瓶.
(2)该小组同学设计如图2装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.

①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;D装置作用安全瓶,E装置中的现象是品红溶液红色褪去
②当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+
③反应装置不完善,为避免空气污染,在图3方框中补全装置图,并注明试剂名称.
(3)从图4选择合适的装置,写出步骤⑤中进行的操作顺序cb(填序号)

(4)步骤⑥中由粗铜得到纯铜的方法为电解精炼(填写名称).
(5)为测定产品中绿矾的质量分数,称取30.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定前尖嘴有气泡,滴定后气泡消失
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.
20.下列实验操作或装置不符合实验要求的是( )
| 选项 | A | B | C | D |
| 操作 | 从CCl4萃取溴水中溴后的混合液中分离 | 二氧化锰与浓盐酸反应制干燥氯气 | 可用于制备并观察氢氧化铁沉淀 | 检查装置气密性 |
| 实验装置 | 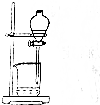 | 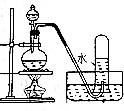 | 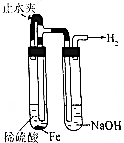 | 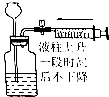 |
| A. | A | B. | B | C. | C | D. | D |
14.已知:C(金刚石,固)→C(石墨,固)+1.9kJ,则下列判断正确的是( )
| A. | 石墨比金刚石稳定 | |
| B. | 等质量的石墨比金刚石能量高 | |
| C. | 发生了物理变化 | |
| D. | 金刚石转化为石墨没有化学键的断裂与生成 |
1.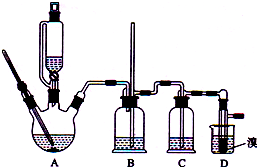 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
19.一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),在一定温度下反应达到平衡,将容器容积缩小到原来的$\frac{1}{2}$,当达到新的平衡时,C的浓度变为原平衡时的1.9倍.若压缩过程中温度恒定,则下列说法中不正确的是( )
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数增大 | D. | A的转化率降低 |
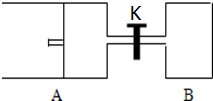 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0达到平衡时,V(A)=1.2aL.试回答:
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0达到平衡时,V(A)=1.2aL.试回答: