��Ŀ����
3��ijʵ��С���ù�ҵ�Ϸ�������Ҫ�ɷ�Cu2S��Fe2O3����ȡ��ͭ���̷���FeSO4•7H2O����Ʒ�����������ͼ1��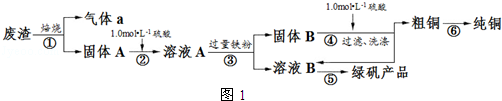
��1����ʵ�����У�����98%��Ũ���ᣨ�ܶ�Ϊ1.84g•mL-1������500mL1.0mol•L-1�����ᣬ��Ҫ����������Ͳ���ձ����������⡢��ͷ�ιܣ�����500mL����ƿ��
��2����С��ͬѧ�����ͼ2װ��ģ������ڹ��������б��գ�����֤�����к���Ԫ�أ�
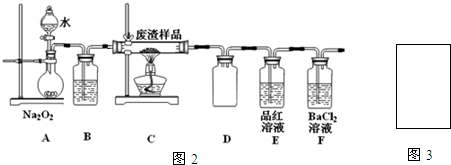
��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2H2O=4NaOH+O2����Dװ�����ð�ȫƿ��Eװ���е�������Ʒ����Һ��ɫ��ȥ
�ڵ�Fװ���г��ְ�ɫ����ʱ����Ӧ���ӷ���ʽΪ2SO2+O2+2H2O+2Ba2+=2BaSO4��+4H+
�۷�Ӧװ�ò����ƣ�Ϊ���������Ⱦ����ͼ3�����в�ȫװ��ͼ����ע���Լ����ƣ�
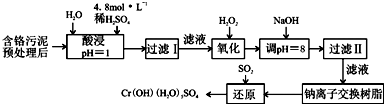
��3����ͼ4ѡ����ʵ�װ�ã�д��������н��еIJ���˳��cb������ţ�
��4����������ɴ�ͭ�õ���ͭ�ķ���Ϊ��⾫������д���ƣ���
��5��Ϊ�ⶨ��Ʒ���̷���������������ȡ30.0g��Ʒ����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol•L-1����KMnO4��Һ���еζ�����ӦΪ��10FeSO4+8H2SO4+2KMnO4�T2MnSO4+5Fe2��SO4��3+K2SO4+8H2O��ʵ���������������ʾ��
| ����� | 1 | 2 | 3 | 4 |
| KMnO4��Һ���/mL | 19.10 | 20.02 | 19.98 | 20.00 |
a����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
b����ƿϴ����δ����
c���ζ��յ�ʱ���Ӷ���
d���ζ�ǰ���������ݣ��ζ���������ʧ
�ڸ��ݱ������ݣ��������ò�Ʒ���̷�����������Ϊ92.7%��
���� ����������Ҫ�ɷ�Cu2S��Fe2O3�����շ������巢����ӦCu2S+2O2$\frac{\underline{\;����\;}}{\;}$SO2+2CuO����������a��SO2������A��CuO��Fe2O3������A��ϡ�����ϣ������ķ�ӦΪCuO+H2SO4=CuSO4+H2O��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��������ҺA�гɷ�ΪCuSO4��Fe2��SO4��3������ҺA�м������Feм��������ӦCuSO4+Fe=FeSO4+Cu��2Fe2��SO4��3+Fe=3FeSO4�����Թ���B�ɷ���Fe��Cu����ҺB�ɷ�ΪFeSO4������B��ϡ�����ϣ�Fe��ϡ���ᷴӦ����FeSO4��Cu��ϡ�����Ӧ�����˵õ������ͭ������������Һ�����ᾧ�õ��̷���
��1����98%��Ũ��������500mL1.0mol•L-1�����ᣬ��Ҫ����������Ͳ���ձ����������⡢��ͷ�ιܣ�����500mL����ƿ��
��2��A���Ʊ�������B��ʢ��Ũ�������������C������ͭ��������Ӧ��D�н����̣ܶ�Ӧ�ǰ�ȫƿ����ֹ��Һ������Eװ�ü����������F�������������ᷴӦ�������ᣬ�������Ȼ�����Һ��Ӧ�������Ҫβ����������ֹ����������Ⱦ������
�ٹ���������ˮ��Ӧ��������������������D��Ϊ��ȫƿ�������������Ư���ԣ�
�������������ᷴӦ�������ᣬ�������Ȼ�����Һ��Ӧ��
��ͼ3������װ��Ϊ���ն�������β������װ�ã�����ʢ������������Һ���õ��µ�©����ֹ������
��3��������Ǵ���Һ�л�þ��壬��Ҫ���м�����������ȴ�ᾧ�����˵Ȳ�����
��4����������ɴ�ͭ�õ���ͭ�ķ���Ϊ��⾫����
��5���ٵ�1��ʵ������ƫС��
��a����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ�����Ը��������ҺŨ�ȱ�ϡ��
b����ƿϴ����δ������ʵ����ʵ���δ�䣻
c���ζ��յ�ʱ���Ӷ�����������Һ���Ϸ����ζ��̶ܿ����϶�������
d���ζ�ǰ���������ݣ��ζ���������ʧ�����������Һ�������Ӧ����ʵ����������
�ڵ�2��3��4������ƽ��ֵΪ���ĸ��������Һ��������ݷ���ʽ�����Ʒ���̷�������������
��� �⣺����������Ҫ�ɷ�Cu2S��Fe2O3�����շ������巢����ӦCu2S+2O2$\frac{\underline{\;����\;}}{\;}$SO2+2CuO����������a��SO2������A��CuO��Fe2O3������A��ϡ�����ϣ������ķ�ӦΪCuO+H2SO4=CuSO4+H2O��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��������ҺA�гɷ�ΪCuSO4��Fe2��SO4��3������ҺA�м������Feм��������ӦCuSO4+Fe=FeSO4+Cu��2Fe2��SO4��3+Fe=3FeSO4�����Թ���B�ɷ���Fe��Cu����ҺB�ɷ�ΪFeSO4������B��ϡ�����ϣ�Fe��ϡ���ᷴӦ����FeSO4��Cu��ϡ�����Ӧ�����˵õ������ͭ������������Һ�����ᾧ�õ��̷���
��1����98%��Ũ��������500mL1.0mol•L-1�����ᣬ��Ҫ����������Ͳ���ձ����������⡢��ͷ�ιܣ�����500mL����ƿ��
�ʴ�Ϊ��500mL����ƿ��
��2��A���Ʊ�������B��ʢ��Ũ�������������C������ͭ��������Ӧ��D�н����̣ܶ�Ӧ�ǰ�ȫƿ����ֹ��Һ������Eװ�ü����������F�������������ᷴӦ�������ᣬ�������Ȼ�����Һ��Ӧ�������Ҫβ����������ֹ����������Ⱦ������
�ٹ���������ˮ��Ӧ����������������������Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����D��Ϊ��ȫƿ�������������Ư���ԣ�Eװ����Ʒ����Һ��ɫ��ȥ��
�ʴ�Ϊ��2Na2O2+2H2O=4NaOH+O2������ȫƿ��Ʒ����Һ��ɫ��ȥ��
�������������ᷴӦ�������ᣬ�������Ȼ�����Һ��Ӧ���ܵķ�Ӧ���ӷ���ʽΪ��2SO2+O2+2H2O+2Ba2+=2BaSO4��+4H+��
�ʴ�Ϊ��2SO2+O2+2H2O+2Ba2+=2BaSO4��+4H+��
��ͼ3������װ��Ϊ���ն�������β������װ�ã�����ʢ������������Һ���õ��µ�©����ֹ������װ��ͼΪ�� ��
��
�ʴ�Ϊ�� ��
��
��3��������Ǵ���Һ�л�þ��壬��Ҫ���м�����������ȴ�ᾧ�����˵Ȳ�����������н��еIJ���˳��Ϊcb��
�ʴ�Ϊ��cb��
��4����������ɴ�ͭ�õ���ͭ�ķ���Ϊ��⾫����
�ʴ�Ϊ����⾫����
��5����a����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ�����Ը��������ҺŨ�ȱ�ϡ���������Ӧƫ��a�����ϣ�
b����ƿϴ����δ������ʵ����ʵ���δ�䣬��Ӱ����������Һ�������b�����ϣ�
c���ζ��յ�ʱ���Ӷ�����������Һ���Ϸ����ζ��̶ܿ����϶������������ƫС����c���ϣ�
d���ζ�ǰ���������ݣ��ζ���������ʧ�����������Һ�������Ӧ����ʵ������������d�����ϣ�
��ѡ��c��
�����ĸ��������Һ���Ϊ$\frac{��20.02+19.98+20.00��mL}{3}$=20mL��
���Ʒ���̷�����������Ϊx����
10FeSO4+8H2SO4+2KMnO4�T2MnSO4+5Fe2��SO4��3+K2SO4+8H2O
1520g 2mol
30g��$\frac{152}{152+126}$��x��$\frac{25mL}{250mL}$ 0.02L��0.1mol/L
����1520g��30g��$\frac{152}{152+126}$��x��$\frac{25mL}{250mL}$=2mol��0.02L��0.1mol/L
���x=92.7%��
�ʴ�Ϊ��92.7%��
���� �����ǻ�ѧ�����������ۺ�ʵ����Ŀ���漰�����ķ�����ᴿ����װ�õķ��������ۡ����ʺ����ⶨ�ȣ����ؿ���ѧ����������������ʵ�������������ȷ���ʵ������ǽⱾ��ؼ����ܴ������Ϸ����������跢���ķ�Ӧ����Ŀ�Ѷ��еȣ�

 �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�| A�� | Zn+H2SO4�TZnSO4+H2�� | B�� | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{��}$2KCl+3O2�� | ||
| C�� | S+O2$\frac{\underline{\;��ȼ\;}}{\;}$SO2 | D�� | H2+Cl2$\frac{\underline{\;��ȼ\;}}{\;}$2HCl |
���Ƹ﹤ҵ����������Ϊԭ�ϣ��������������۸��Ĺ���������ͼ��ʾ���������ȡҺ�н���������Ҫ��Cr3+�������Fe3+��Al3+��Cu2+��Mg2+����
���������ӳ�����������������ʽ����ʱ��Һ��pH���±���
| ������ | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| ��ʼ����ʱ��pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| ������ȫʱ��pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 ����9�ܽ⣩ |
A��������������鲢�ʵ��ӳ���ȡʱ�� B�������¶Ȳ��Ͻ��� C����ν�ȡ���ϲ���ȡҺ D�����̽�ȡʱ��
��2�����������м���H2O2�������ܰ�Cr3+����ΪCr2O72-�⣬��һ��������2Fe2++2H++H2O2=2Fe3++2H2O�������ӷ���ʽ��ʾ��
��3�����ˢ�����ij�����Fe��OH��3��Al��OH��3��Cu��OH��2�����ѧʽ��
��4�������ӽ�����֬��ԭ��Ϊ��Mn++nNaR��MRn+nNa+��������������������Ca2+��Mg2+�������ӷ��ţ�
��5��ÿ����1molCr��OH����H2O��3SO4������SO2�����ʵ���Ϊ1.5mol
��6����ҵ�Ͽ��õ�ⷨ������Cr2O72-�����Է�ˮ�����巽���ǽ���Cr2O72-�����Է�ˮ��������ڣ�����������NaCl��������ʯīΪ�缫���е�⣬����һ��ʱ�������Cr��OH��3��Fe��OH��3������ȥ
�����缫��ֱ����Դ�������������������������������������NaCl��Ŀ����������Һ��������
�����������Һ��c��Fe3+��Ϊ2.0��10-13mol•L-1������Һ��Ϊ3.0��10-6mol/L����֪Ksp[Fe��OH��3]=4.0��10-38��Ksp[Fe��OH��3]=6.0��10-31��
| A�� | ��Ҫ����480mL����Һ��Ӧѡ��500mL����ƿ | |
| B�� | ����NaOH��ŵ��ձ��г��� | |
| C�� | �ѳƺõĹ����ˮ�ܽ������ת�Ƶ�����ƿ�� | |
| D�� | ����ʱ���ӿ̶��ߣ�����NaOH��ҺŨ�Ȼ�ƫ�� |
 ��������ȷ���ǣ�������
��������ȷ���ǣ�������| A�� | 1-��-3-�һ��� | B�� | 1-��-3-����ϩ | C�� | �������ϩ | D�� | ���һ��ױ� |
| �¶ȡ� | 400 | 500 | 830 | 1000 |
| ƽ������K | 10 | 9 | 1 | 0.6 |
| A�� | ������Ӧ������Ӧ�����ȷ�Ӧ | |
| B�� | �÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=$\frac{\{c��{H}_{2}��•c��C{O}_{2}��\}}{\{c��CO��•c��{H}_{2}O��\}}$ | |
| C�� | �÷�Ӧ��400��ʱ��ƽ��״̬���������¶ȣ�������Ӧ���ʼ�С���淴Ӧ�������� | |
| D�� | ��830�棬2L���ܱ������У�����1molCO��5molH2O��g����3molCO2��2molH2����������Ӧ���ڴﵽƽ��ǰV��������V���棩 |
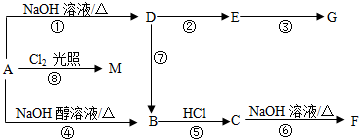
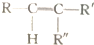 $\stackrel{�������������Һ}{��}$R-COOH+
$\stackrel{�������������Һ}{��}$R-COOH+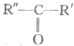
 ��HOOC��CH2��4COOH��
��HOOC��CH2��4COOH��