题目内容
18.摩尔熵是单位物质的量的物质在一定条件下所具有的熵.试比较下列两组物质摩尔熵的大小顺序.(1)相同条件下的气态甲醇、乙醇、丙醇S(气态甲醇)<S(气态乙醇)<S(气态丙醇).
(2)气态苯、液态苯、固态苯S(固态苯)<S(液态苯)<S(气态苯).
分析 (1)一般来讲,组成物质的原子种类相同时,一个分子中的原子数目越多,其混乱度就越大,熵值就越大;
(2)对于同一种物质,S(s)<S(l)<S(g),由此分析解答.
解答 解:(1)相同条件下的气态甲醇、乙醇、丙醇,原子数由少到多的顺序为:甲醇<乙醇<丙醇,而分子中的原子数目越多,其混乱度就越大,熵值就越大,所以S(气态甲醇)<S(气态乙醇)<S(气态丙醇),故答案为:S(气态甲醇)<S(气态乙醇)<S(气态丙醇);
(2)对于同一种物质,S(s)<S(l)<S(g),所以S(固态苯)<S(液态苯)<S(气态苯),故答案为:S(固态苯)<S(液态苯)<S(气态苯).
点评 本题考查反应热和焓变的相关知识,学生要清楚一个分子中的原子数目越多,其混乱度就越大,熵值就越大就可以迅速解题比较容易.

练习册系列答案
相关题目
11.铬及其化合物在工业上有许多用途,但化工废料铬渣对人体健康有很大危害.
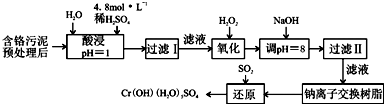
以制革工业产生的污泥为原料,回收污泥中三价铬的工艺流程如图所示,(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)能提高酸浸时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间 B.升高温度不断搅拌 C.多次浸取,合并浸取液 D.缩短浸取时间
(2)氧化过程中加入H2O2,除了能把Cr3+氧化为Cr2O72-外,另一个作用是2Fe2++2H++H2O2=2Fe3++2H2O(用离子方程式表示)
(3)过滤Ⅱ产生的沉淀是Fe(OH)3、Al(OH)3、Cu(OH)2,(填化学式)
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+,Mg2+(填离子符号)
(5)每生成1molCr(OH)(H2O)3SO4,消耗SO2的物质的量为1.5mol
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解,经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去
①铁电极与直流电源的正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)3]=6.0×10-31)
以制革工业产生的污泥为原料,回收污泥中三价铬的工艺流程如图所示,(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
A.将含铬污泥粉碎并适当延长浸取时间 B.升高温度不断搅拌 C.多次浸取,合并浸取液 D.缩短浸取时间
(2)氧化过程中加入H2O2,除了能把Cr3+氧化为Cr2O72-外,另一个作用是2Fe2++2H++H2O2=2Fe3++2H2O(用离子方程式表示)
(3)过滤Ⅱ产生的沉淀是Fe(OH)3、Al(OH)3、Cu(OH)2,(填化学式)
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+,Mg2+(填离子符号)
(5)每生成1molCr(OH)(H2O)3SO4,消耗SO2的物质的量为1.5mol
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解,经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去
①铁电极与直流电源的正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)3]=6.0×10-31)
3.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
①4FeO•Cr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3═2NaAlO2+CO2↑
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是由于存在反应平衡Cr2O72-+H2O?2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-..
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl
表是相关物质的溶解度数据:
①该反应能发生的理由是温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,低温下四种物质中K2Cr2O7的溶解度最小,利用复分解反应在低温下可以得到重铬酸钾.
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热浓缩、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
①4FeO•Cr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3═2NaAlO2+CO2↑
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是由于存在反应平衡Cr2O72-+H2O?2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-..
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl
表是相关物质的溶解度数据:
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热浓缩、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
10.煤化工中常将研究不同温度下的平衡常数,投料比及产率等问题,已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表:下列叙述正确的是( )
| 温度℃ | 400 | 500 | 830 | 1000 |
| 平均常数K | 10 | 9 | 1 | 0.6 |
| A. | 上述反应中正反应是吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{\{c({H}_{2})•c(C{O}_{2})\}}{\{c(CO)•c({H}_{2}O)\}}$ | |
| C. | 该反应在400℃时达平衡状态,若升高温度,则正反应速率减小,逆反应速率增大 | |
| D. | 在830℃,2L的密闭容器中,冲入1molCO、5molH2O(g)、3molCO2和2molH2发生上述反应,在达到平衡前V(正)<V(逆) |
7.在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )
| A. | 制催化剂的材料 | B. | 耐高温、耐腐蚀的合金材料 | ||
| C. | 半导体材料 | D. | 制农药的材料 |
 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体.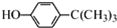 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: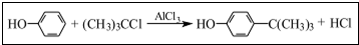 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.