题目内容
19.用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中不可能出现的结果是( )| A. | c(NH4+)>c(Cl-),c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+),c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+),c(H+)>c(OH-) | D. | c(NH4+)=c(Cl-),c(OH-)=c(H+) |
分析 用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,无论溶液中的溶质是氯化铵,还是氯化铵和氯化氢、氯化铵和一水合氨,所得溶液一定不显电性,则利用遵循电荷守恒来分析解答.
解答 解:A.若滴定后溶液中的溶质为氯化铵和一水合氨,则一般溶液显碱性,即c(OH-)>c(H+),溶液中弱电解质的电离>盐的水解,即c(NH4+)>c(Cl-),符合电荷守恒,则A是可能出现的结果,故A错误;
B.当c(Cl-)>c(NH4+),c(OH-)>c(H+),则溶液中阴离子带的电荷总数就大于阳离子带的电荷总数,显然与电荷守恒矛盾,故B是不可能出现的结果,则B正确;
C.若滴定后溶液中的溶质为氯化铵,由铵根离子水解则溶液显酸性,即c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+),且符合电荷守恒,则C是可能出现的结果,故C错误;
D.若滴定后溶液中的溶质为氯化铵和一水合氨,当溶液中弱电解质的电离程度与盐的水解程度相同时,溶液为中性,则c(OH-)=c(H+),由电荷守恒可知c(NH4+)=c(Cl-),则D是可能出现的结果,故D错误;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,明确电荷守恒的含义及盐的水解原理为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
10.某化学研究性学习小组拟利用下列装置和药品进行四氯化锡的制备.供选择的药品:4.8gSn、浓HCl、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰.
仪器装置:
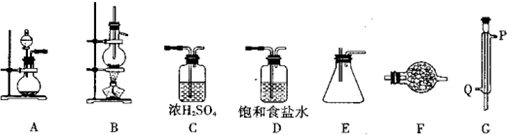
已知四氯化锡具有强的吸水性,水解生成锡的氧化物.SnCl4和Sn的部分数据如下:
请回答下列相关问题:
(1)实验时装置的正确连接顺序为AD→C→B→G→E→F
(2)仪器G的名称是冷凝管实验时,冷却水的流向是从Q进入(填符号)
(3)A中反应的离子方程式2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)F中盛装的化学试剂是碱石灰;;作用是防止空气中的水分进入装置E中、吸收多余的Cl2防止污染.写出SnCl4水解的化学方程式SnCl4+4H2O=Sn(OH)4+4HCl
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是90%.
仪器装置:

已知四氯化锡具有强的吸水性,水解生成锡的氧化物.SnCl4和Sn的部分数据如下:
| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
(1)实验时装置的正确连接顺序为AD→C→B→G→E→F
(2)仪器G的名称是冷凝管实验时,冷却水的流向是从Q进入(填符号)
(3)A中反应的离子方程式2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)F中盛装的化学试剂是碱石灰;;作用是防止空气中的水分进入装置E中、吸收多余的Cl2防止污染.写出SnCl4水解的化学方程式SnCl4+4H2O=Sn(OH)4+4HCl
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是90%.
14.下列有关叙述中正确的是( )
| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 同一弱电解质溶液,温度不同时,导电能力相同 |
11.下列关于有机物的分析正确的是( )
| A. | 间二甲苯的二氯代物有5种 | |
| B. | 二氯甲烷有2种同分异构体 | |
| C. | 丙烯分子中所有的原子有可能在同一平面上 | |
| D. | 用-C4H9取代苯环上的1个氢原子,最多可得4种同分异构体 |
8.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液下列正确的操作顺序是( )
| A. | ①④②⑤③ | B. | ⑤②①④③ | C. | ②⑤④①③ | D. | ④①②⑤③ |
9.为了确认电解质溶液X的成分,某同学做了以下两组实验,请根据实验回答问题:
(1)实验步骤Ⅰ中无明显现象,实验步骤Ⅱ中发现溶液变红色,相关的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3;
(2)实验步骤Ⅲ中反应的离子方程式为:Cl-+Ag+=AgCl↓;
(3)实验一证明X溶液中含Fe2+离子,实验Ⅱ证明X溶液中含Cl-离子.(填离子符号)
| 编号 | Ⅰ | Ⅱ |
| 实验一 | 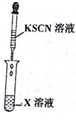  | 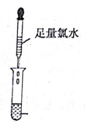 |
| 编号 | Ⅲ | |
| 实验二 |  | |
(2)实验步骤Ⅲ中反应的离子方程式为:Cl-+Ag+=AgCl↓;
(3)实验一证明X溶液中含Fe2+离子,实验Ⅱ证明X溶液中含Cl-离子.(填离子符号)
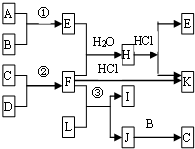 如图是部分短周期元素的单质及其化合物的转化关系图
如图是部分短周期元素的单质及其化合物的转化关系图 [Al(OH)2]++H+.
[Al(OH)2]++H+.