题目内容
5.已知将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 由上述原理可推知H2的燃烧热为241.9 kJ/mol | |
| C. | 反应②中的能量变化可用图表示: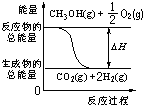 | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
分析 A、利用盖斯定律,②×3-①×2可得甲醇燃烧的热化学方程式,进而可知甲醇的燃烧热;
B、根据根据盖斯定律来计算化学反应的焓变;
C、根据已知的甲醇转化为氢气的两种反应原理来判断;
D、根据物质的能量大小与物质的状态关系来判断.
解答 解:A、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以甲醇的燃烧热为676.7kJ/mol,故A错误;
B、根据已知两个反应:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol,
②CH3OH(g)+0.5O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol,②×2-2×①可以得到反应2H2(g)+O2 (g)=2H2O (g),所以该反应的焓变△H=2×(-192.9kJ/mol)-2×49.0kJ/mol=-483.8kJ/mol,即mol氢气燃烧的燃烧热为:-241.9kJ/mol,故B正确;
C、由已知可知,反应①为吸热反应,而反应②为放热反应,即反应物的总能量高于生成物的总能量,故C正确;
D、CH3OH转变成H2的过程按照反应①是吸热反应,按照②反应是放热反应,所以不一定要吸收能量,故D错误;
故选BC.
点评 本题考查化学反应的反应热的计算.注意在比较反应热大小时要带符号比较,并注意盖斯定律的应用来解答.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
15.在含有CO${\;}_{3}^{2-}$且能使酚酞试液变红的无色溶液中,能大量共存的离子组是( )
| A. | Na+、SO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、K+ | B. | Na+、Cu2+、Br-、Ba2+ | ||
| C. | K+、MnO${\;}_{4}^{-}$、NO${\;}_{3}^{-}$、Na+ | D. | K+、Ca2+、SO${\;}_{3}^{2-}$、Cl- |
16.下列鉴别物质的方法能达到目的是( )
| A. | 用Br2的CCl4溶液鉴别CH2=CH2和HC≡CH | |
| B. | 用AgNO3溶液鉴别KCl溶液和MgCl2溶液 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 |
13.以下物理量只与温度有关的是( )
| A. | 合成氨工业中,氢气的转化率 | B. | 醋酸钠的水解程度 | ||
| C. | 水的离子积 | D. | 氢气的溶解度 |
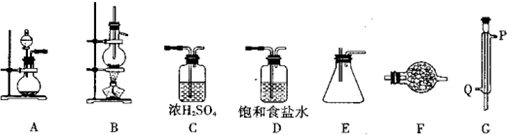
10.某化学研究性学习小组拟利用下列装置和药品进行四氯化锡的制备.供选择的药品:4.8gSn、浓HCl、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰.
仪器装置:
已知四氯化锡具有强的吸水性,水解生成锡的氧化物.SnCl4和Sn的部分数据如下:
请回答下列相关问题:
(1)实验时装置的正确连接顺序为AD→C→B→G→E→F
(2)仪器G的名称是冷凝管实验时,冷却水的流向是从Q进入(填符号)
(3)A中反应的离子方程式2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)F中盛装的化学试剂是碱石灰;;作用是防止空气中的水分进入装置E中、吸收多余的Cl2防止污染.写出SnCl4水解的化学方程式SnCl4+4H2O=Sn(OH)4+4HCl
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是90%.
仪器装置:

已知四氯化锡具有强的吸水性,水解生成锡的氧化物.SnCl4和Sn的部分数据如下:
| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
(1)实验时装置的正确连接顺序为AD→C→B→G→E→F
(2)仪器G的名称是冷凝管实验时,冷却水的流向是从Q进入(填符号)
(3)A中反应的离子方程式2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)F中盛装的化学试剂是碱石灰;;作用是防止空气中的水分进入装置E中、吸收多余的Cl2防止污染.写出SnCl4水解的化学方程式SnCl4+4H2O=Sn(OH)4+4HCl
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是90%.
14.下列有关叙述中正确的是( )
| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 同一弱电解质溶液,温度不同时,导电能力相同 |
15.如图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是( )


| A. | 甲:NaOH; 乙:稀盐酸 | B. | 甲:水; 乙:氢氧化钠溶液 | ||
| C. | 甲:氢氧化钠溶液; 乙:水 | D. | 甲:稀盐酸; 乙:氯化钠溶液 |
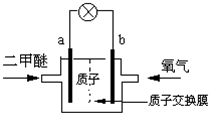 新能源开发中的燃料电池是低碳研究的重要领域.
新能源开发中的燃料电池是低碳研究的重要领域. 有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验: