题目内容
1.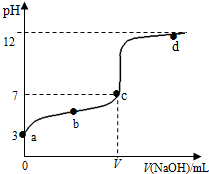 在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:
在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡体系是A-+H2O?HA+OH-、H2O?H++OH-;
溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+);
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是c>b>a>d.
(4)该温度下,滴定曲线上c点时HA的电离平衡常数Ka=$\frac{1{0}^{-7}V}{20-V}$.(用含V的代数简式表示)
分析 (1)根据图象找出突跃范围为:7.7-9.7,指示剂的变色点在突跃范围内;
(2)由图象可知HA为弱酸,二者恰好反应时生成的盐为强碱弱酸盐,其溶液呈碱性,溶液中存在弱酸根离子的水解平衡、弱电解质的电离平衡,结合电荷守恒判断离子浓度大小;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离;
(4)电离平衡常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$;
解答 解:(1)根据图象找出突跃范围为:7.7-9.7,酚酞的变色范围为8.2-10,所以选取酚酞试液作指示剂;
故答案为:酚酞;
(2)向由图象可知HA为弱酸,20mL 0.1mol•L-1 某酸HA溶液中逐滴加入0.1mol•L-1 NaOH溶液,当V (NaOH)=20.00mL时,恰好反应生成生成NaA,NaA中弱酸根离子能水解而使其溶液呈碱性,水是弱电解质,存在电离平衡,所以溶液中存在的平衡为:A-+H2O?HA+OH-和H2O?H++OH-,
溶液呈碱性则:c(OH-)>c(H+),溶液中存在电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),所以得c(Na+)>c(A-),溶液中盐类水解程度微弱,所以离子浓度大小顺序是:c(Na+)>c(A-)>c(OH-)>c(H+);
故答案为:A-+H2O?HA+OH-;H2O?H++OH-;c(Na+)>c(A-)>c(OH-)>c(H+);
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大,抑制水电离程度越大,从图象可以得出,a点由水电离c(H+)=c(OH-)=10-11mol/L,d点由水电离c(H+)=c(OH-)=10-12mol/L,故电离程度a>d,b点抑制程度比a弱,因此b>a,c点抑制程度最弱,所以水的电离程度从大到小顺序是:c>b>a>d;
故答案为:c>b>a>d;
(4)NaA为强碱弱酸盐,其溶液呈碱性,要使溶液呈中性,则酸应该稍微过量,呈中性时,溶液中c(Na+)=c(A-)=$\frac{0.1×V}{20+V}$mol/L,c(HA)=$\frac{0.1×(20-V)}{20+V}$,电离平衡常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-7}•\frac{0.1×V}{20+V}}{\frac{0.1(20-V)}{20+V}}$=$\frac{1{0}^{-7}V}{20-V}$;
故答案为:$\frac{1{0}^{-7}V}{20-V}$;
点评 本题考查了酸碱中和滴定实验,根据溶液浓度和溶液PH确定酸的强弱,再结合酸或碱、盐对水电离的影响、电离平衡常数等知识点来分析解答,难点是(4),注意混合溶液中钠离子和HA浓度的计算方法,难度中等.

| A. | Ca2+、Na+、CO32- | B. | Na+、Ca2+、HCO3- | C. | K+、Na+、NO3-. | D. | NH4+、SO42-、Cu2+ |
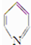 )与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
)与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
| A. | M能使酸性高锰酸钾溶液褪色 | |
| B. | 1molM与金属钠反应,消耗2mol Na | |
| C. | 1mol磷酸吡醛与NaOH溶液反应,最多消耗3mol NaOH | |
| D. | M与足量H2反应后所得有机物的分子式为C8H17O3N |
| A. | CH4 | B. | C2H4 | C. | C3H8 | D. | C6H6 |
| A. |  | B. | CH2═CH-CH═CH2 | C. |  | D. |  |
| A. | 加稀盐酸 | B. | 加NaOH溶液 | C. | 焰色反应 | D. | 加热 |
| A. | 足量Zn与一定量的浓硫酸反应,产生22.4 L(标况)气体时,转移的电子数一定为2NA | |
| B. | 2 molSO2和1 molO2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA | |
| C. | 71g氯气通入足量水中,反应中转移的电子总数为NA | |
| D. | 6 g SiO2晶体中含有的硅氧键数为0.4NA |