题目内容
11.阿伏加德罗常数为NA,下列说法中不正确的是( )| A. | 足量Zn与一定量的浓硫酸反应,产生22.4 L(标况)气体时,转移的电子数一定为2NA | |
| B. | 2 molSO2和1 molO2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA | |
| C. | 71g氯气通入足量水中,反应中转移的电子总数为NA | |
| D. | 6 g SiO2晶体中含有的硅氧键数为0.4NA |
分析 A.标准状况下22.4L气体的物质的量为1mol,足量锌与浓硫酸反应生成的气体组成为二氧化硫和氢气,无论生成氢气还是二氧化硫,生成1mol气体都得到2mol电子;
B.二氧化硫和氧气反应存在化学平衡分析;
C.n=$\frac{m}{M}$计算物质的量,结合氯气和水反应是可逆反应不能进行彻底分析;
D.1molSiO2晶体存在4molSi-O键;
解答 解:A.足量Zn与一定量的浓硫酸反应,产生的气体为氢气和二氧化硫的混合气体,标准状况下22.4L气体的物质的量为1mol,生成1mol二氧化硫和氢气的混合气体,转移了2mol电子,转移的电子数为2NA,故A正确;
B.二氧化硫和氧气反应是体积减小的反应,若恰好反应生成三氧化硫应为2mol,但反应存在化学平衡;容器内物质分子数大于2NA,故B正确;
C.71g氯气物质的量为1mol,通入足量水中,氯气和水反应是可逆反应不能进行彻底,反应中转移的电子总数小于NA,故C错误;
D.1molSiO2晶体存在4molSi-O键,所以6gSiO2晶体物质的量n=$\frac{6g}{60g/mol}$=0.1mol,即1mol含有0.4molSi-O键,硅氧键数为0.4NA,故D正确;
故选C.
点评 本题考查了阿伏伽德罗常数,主要是氧化还原反应电子转移计算、化学平衡分析、物质结构的理解应用,作为物质的量和微粒数关系是解题关键,题目难度中等.

练习册系列答案
相关题目
1.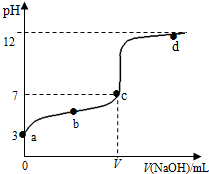 在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:
在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:
(1)实验中的指示剂最好使用酚酞;
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡体系是A-+H2O?HA+OH-、H2O?H++OH-;
溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+);
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是c>b>a>d.
(4)该温度下,滴定曲线上c点时HA的电离平衡常数Ka=$\frac{1{0}^{-7}V}{20-V}$.(用含V的代数简式表示)
 在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:
在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡体系是A-+H2O?HA+OH-、H2O?H++OH-;
溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+);
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是c>b>a>d.
(4)该温度下,滴定曲线上c点时HA的电离平衡常数Ka=$\frac{1{0}^{-7}V}{20-V}$.(用含V的代数简式表示)
19.试管中盛有少量白色固体,可能是铵盐,检验的方法是( )
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加水,将湿润的红色石蕊试纸放在试管口 | |
| C. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
3.下列物质间有如下反应关系,已知A是某两种溶质的混合溶液,判断下列选项正确的是( )

| A. | 气体C是SO2 | |
| B. | 溶液A和溶液B可能的化学反应为3Na2S+Na2SO3+4H2SO4=3S↓+H2S↑+4Na2SO4+3H2O | |
| C. | 若氧气足量气体C可以一步反应得到气体Y | |
| D. | 图中少量X通入溶液F中不涉及氧化还原反应 |
20.下列说法正确的是( )
| A. | 正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 | |
| B. | 乙醇依次通过消去、取代、加成反应可生成乙二醇 | |
| C. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
11.下列说法错误的是( )
| A. | C3H8是折线形极性分子 | |
| B. | 只有过渡金属才能接受电子对形成配合物 | |
| C. | 乳酸[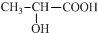 ]中存在一个手性碳原子 ]中存在一个手性碳原子 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子,而HClO中非羟基氧原子个数为0 |
 .
.

 .
.