题目内容
14.SO2是一种大气污染物,它可以再一定条件下通过下列反应来消除.2CaCO3+2SO2+O2→2CaSO4+2CO2
如果反应中SO2的转化率为97%,当消耗6.6gSO2时,生成CaSO4的质量时多少?
分析 SO2的转化百分率为97%,消耗6.6gSO2,实际上转化的二氧化硫质量=6.6g×97%=6.402g,根据S原子守恒计算硫酸钙的质量.
解答 解:SO2的转化百分率为97%,要吸收6.6gSO2,实际上转化的二氧化硫质量=6.6g×97%=6.402g,根据S原子守恒得n(CaSO4)=n(SO2)=$\frac{6.402g}{64g/mol}$,m(CaSO4)=$\frac{6.402g}{64g/mol}$×136g/mol≈13.6g,
答:SO2的转化百分率为97%,当消耗6.6gSO2时,生成CaSO4的质量是13.6g.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确原子守恒内涵是解本题关键,注意单位之间的换算,题目难度不大.

练习册系列答案
相关题目
4.氨溶于水的喷泉实验中,形成喷泉的原理是( )
| A. | 氨气易液化 | |
| B. | 氨水呈碱性 | |
| C. | 氨气极易溶于水,使烧瓶内外形成压强差 | |
| D. | 氨气溶于水后形成的溶液易挥发 |
9.将2mol A气体和1mol B气体在固定体积的密闭容器中混合并在一定条件下发生如下反应并达到平衡状态:2A(g)+B(g)?2C(g),此反应为放热反应.下列能增大正、逆反应速率的方法是:
(1)再充入1mol A气体;(2)充入2mol的惰性气体;(3)加入正催化剂;(4)升高温度;(5)移走部分C气体.
其中正确的是( )
(1)再充入1mol A气体;(2)充入2mol的惰性气体;(3)加入正催化剂;(4)升高温度;(5)移走部分C气体.
其中正确的是( )
| A. | (1)(3)(5) | B. | (1)(3)(4) | C. | (1)(2)(4)(5) | D. | (1)(2)(3)(4)(5) |
19.下列说法正确的是( )
| A. | 离子键是阴阳离子之间的静电引力 | |
| B. | 只有原子才满足核内质子数和核外电子数相等 | |
| C. | 离子化合物中一定有金属元素 | |
| D. | 氕、氘、氚互为氢元索的同位素,H2O、D2O和T2O是不同的分子 |
1.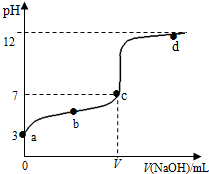 在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:
在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:
(1)实验中的指示剂最好使用酚酞;
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡体系是A-+H2O?HA+OH-、H2O?H++OH-;
溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+);
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是c>b>a>d.
(4)该温度下,滴定曲线上c点时HA的电离平衡常数Ka=$\frac{1{0}^{-7}V}{20-V}$.(用含V的代数简式表示)
 在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:
在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡体系是A-+H2O?HA+OH-、H2O?H++OH-;
溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+);
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是c>b>a>d.
(4)该温度下,滴定曲线上c点时HA的电离平衡常数Ka=$\frac{1{0}^{-7}V}{20-V}$.(用含V的代数简式表示)
18.如表为某食品包装袋上的说明书:
(1)选择说明书中的物质回答下面的问题:
①能水解生成氨基酸的物质是蛋白质.
②若人体缺少维生素A,易患夜盲症.
(2)对芝麻酱说明书的判断正确的是C (填序号).
A.不含微量元素 B.不含糖类和油脂
C.婴儿最不宜食用 D.钙含量低于豆腐和鸡蛋.
| 芝麻酱每100 g含有 蛋白质:19.2 g 脂肪:52.7 g 碳水化合物16.8 g 维生素 A:17 μg 铁:50.3 mg 硒:4 μg 含钙:相当于300 g豆腐 含铁:相当于800 g鸡蛋 (提醒:芝麻酱可引起部分婴儿过敏性皮炎) |
①能水解生成氨基酸的物质是蛋白质.
②若人体缺少维生素A,易患夜盲症.
(2)对芝麻酱说明书的判断正确的是C (填序号).
A.不含微量元素 B.不含糖类和油脂
C.婴儿最不宜食用 D.钙含量低于豆腐和鸡蛋.
19.试管中盛有少量白色固体,可能是铵盐,检验的方法是( )
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加水,将湿润的红色石蕊试纸放在试管口 | |
| C. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
 ,反应类型加聚反应.
,反应类型加聚反应.
