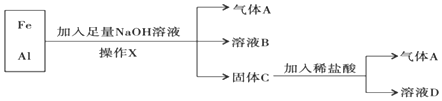
题目内容
5.在同温同压下,同质量的SO2气体和SO3气体的体积之比5:4,密度之比4:5,氧原子的数目之比5:6.分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$、ρ=$\frac{M}{{V}_{m}}$计算同温同压下同质量的SO2气体和SO3气体的体积、密度及含有氧原子数之比.
解答 解:根据n=$\frac{m}{M}$可知,同质量的SO2气体和SO3气体的物质的量与其摩尔质量成反比,则二者物质的量之比=80g/mol:64g/mol=5:4,相同条件下气体摩尔体积相同,则SO2和SO3的体积与其物质的量成正比,SO2和SO3的体积之比=5:4;
根据ρ=$\frac{M}{{V}_{m}}$可知,相同条件下气体密度与摩尔质量成正比,则SO2和SO3的密度之比=64g/mol:80g/mol=4:5;
根据N=nNA可知,二者含有氧原子的数目之比等于氧原子的物质的量之比=(5×2):(4×3)=5:6,
故答案为:5:4;4:5;5:6.
点评 本题考查了物质的量的计算,题目难度不大,明确密度与摩尔质量的关系为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数等之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
20.一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g),达到平衡后测得A气体的浓度为1mol•L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol•L-1,则下列叙述正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y=z | ||
| C. | C的体积分数升高 | D. | B的转化率降低 |
10.下列关于浓硫酸的叙述正确的是( )
| A. | 浓硫酸具有脱水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体 | |
| D. | 因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸 |
15.下列实验操作能达到实验目的是( )
| A. | 向生石灰中滴加浓氨水,可以制备氨气 | |
| B. | 用分液漏斗、烧杯、铁架台可以分离碘的四氯化碳溶液 | |
| C. | 用排饱和硝酸钾溶液的方法可以收集铜与浓硝酸产生的NO2 | |
| D. | 在含少量AlCl3的MgCl2溶液中加人过量MgO,过滤得到MgCl2溶液 |
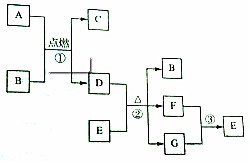 有关物质的转化关系如图所示(部分物质和条件已略去).A是金属单质,D是非金属单质,B、F是气体且B无色无味,G是最常见的无色液体.请回答下列问题:
有关物质的转化关系如图所示(部分物质和条件已略去).A是金属单质,D是非金属单质,B、F是气体且B无色无味,G是最常见的无色液体.请回答下列问题: ;
; .
.