题目内容
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.1mol对苯二甲酸中含有双键的数目为0.2NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | Fe在少量Cl2中燃烧生成0.5 mol产物,转移的电子数为NA | |
| D. | 标准状况下,2.24L H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
分析 A、对苯二甲酸中含2条双键;
B、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
C、铁在氯气中燃烧生成氯化铁,即铁元素变为+3价;
D、求出H2S的物质的量,然后根据H2S溶于水后部分电离为HS-和S2-离子来分析.
解答 解:A、苯环不含双键,故0.11mol对苯二甲酸中只含0.2mol碳氧双键,即0.2NA条,故A正确;
B、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中含有的氢氧根的物质的量为0.1mol,个数为0.1NA个,故B错误;
C、铁在氯气中燃烧生成氯化铁,即铁元素变为+3价,故当生成0.5mol氯化铁时,转移1.5NA个电子,故C错误;
D、标况下2.24LH2S的物质的量为0.1mol,而H2S是弱电解质,溶于水后只能部分电离为HS-和S2-离子,故所得溶液中的H2S、HS-和S2-离子的个数之和为0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
15.科研、生产、生活中离不开溶液的浓度,相关物质的浓度描述可信的是( )
| A. | 5mol/L 氢硫酸溶液 | B. | 18.4mol/L 盐酸溶液 | ||
| C. | 含甲醛40%的福尔马林溶液 | D. | 含乙酸12%的食醋溶液 |
12.下列说法中正确的是( )
| A. | 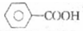 的同分异构体中能发生银镜反应的芳香族化合物有4种 的同分异构体中能发生银镜反应的芳香族化合物有4种 | |
| B. | 纤维素在人体中水解的最终产物是葡萄糖 | |
| C. | 烷烃与聚乙烯结构中均有碳碳单键 | |
| D. | 0.1mol 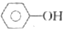 和 和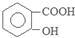 的混合物完全燃烧消耗O215.68L 的混合物完全燃烧消耗O215.68L |
19.NA代表阿伏加德罗常数的数值.下列说法不正确的是( )
| A. | 0.05 mol液态KHSO4中含有0.05 NA个阳离子 | |
| B. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA | |
| C. | 常温下,100 mL 1 mol•L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA |
16.下列指定反应的离子方程式正确的是( )
| A. | 铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H+═2Fe3++3H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
13.设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 若1mol•L-1HF溶液中H+数目为NA,则等体积的2mol•L-1HF溶液中H+数目为2NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36g3H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
14.削过皮的苹果过一段时间后颜色就会由白色变为褐色,食品科学上称为“褐变”.某研究性学习小组查阅有关资料,发现不同文献解释不同.
I、《化学教学》:苹果中Fe2+被空气中的O2氧化成Fe3+而变色.
II、《中学化学教学参考》:苹果中的酚类物质在苹果中的氧化酶催化下被空气中的O2氧化而生成有色物质.
已知酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色.如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
(1)为探究苹果“褐变”是否为I的原因,该小组同学设计了如下实验:
①刚削皮的苹果立刻滴上2~3滴A溶液,继而再滴上几滴氯水.
②在“褐变”后的苹果上滴上2~3滴A溶液.
回答下列问题:
A溶液是KSCN溶液(填化学式).若I的解释正确,写出①中有关的离子方程式:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3 此空删去;上述①②的实验现象应为:①滴加A溶液时,无明显现象,再滴加几滴氯水,变红色;②变红色.经实验,①②均无明显现象,说明观点I的解释是错误的.
(2)为探究苹果“褐变”是否为II的原因,该小组同学又设计了如下实验.请帮他们在表中完善实验③、④探究目的和结论.
I、《化学教学》:苹果中Fe2+被空气中的O2氧化成Fe3+而变色.
II、《中学化学教学参考》:苹果中的酚类物质在苹果中的氧化酶催化下被空气中的O2氧化而生成有色物质.
已知酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色.如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
(1)为探究苹果“褐变”是否为I的原因,该小组同学设计了如下实验:
①刚削皮的苹果立刻滴上2~3滴A溶液,继而再滴上几滴氯水.
②在“褐变”后的苹果上滴上2~3滴A溶液.
回答下列问题:
A溶液是KSCN溶液(填化学式).若I的解释正确,写出①中有关的离子方程式:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3 此空删去;上述①②的实验现象应为:①滴加A溶液时,无明显现象,再滴加几滴氯水,变红色;②变红色.经实验,①②均无明显现象,说明观点I的解释是错误的.
(2)为探究苹果“褐变”是否为II的原因,该小组同学又设计了如下实验.请帮他们在表中完善实验③、④探究目的和结论.
| 序号 | 实 验 步 骤 | 现 象 | 探究目的和结论 |
| ③ | 将刚削皮的苹果立刻放入隔绝空气的环境中 | 相当长一段时间内,无明显变化 | 探究目的:探究空气中的O2对苹果“褐变”的影响 结论:“褐变”是苹果中的某些物质与空气中的O2发生反应,生成有色物质.(或没有空气O2的参与,苹果不发生“褐变” |
| ④ | 将刚削皮的苹果立刻放入90℃~95℃的水中2min,再放在空气中. 再将另一块刚削皮的苹果立刻放入稀盐酸中浸泡2min后取出洗净,再放在空气中.将盐酸改为酒精、醋酸铅溶液进行相同实验. | 相当长一段时间内,均无明显变化 | 探究目的:探究氧化酶对苹果“褐变”的影响 结论:经加热或稀盐酸浸泡,酶变性而失去催化能力,没有氧化酶的催化,苹果不发生“褐变”.(或苹果发生“褐变”,必须在氧化酶的催化下才能发生. . |
| ⑤ | 在刚削皮的苹果上滴加FeCl3溶液. | 苹果由白色变为绿色 | 探究目的:探究苹果中是否含有酚类物质. 结论:苹果中含有酚类物质. |
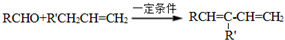
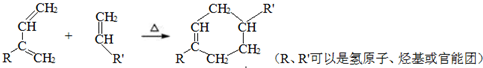
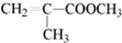 .
.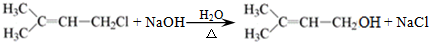 .
.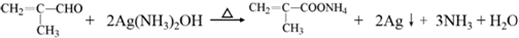 .
.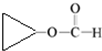 .
.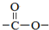 结构.
结构.