题目内容
16.下列指定反应的离子方程式正确的是( )| A. | 铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H+═2Fe3++3H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
分析 A.2mol铝与氢氧化钠溶液反应生成3mol氢气,该反应不满足电子守恒、电荷守恒;
B.氯气过量,亚铁离子和溴离子都完全被氧化,溴离子的计量数应该为4;
C.铁离子具有氧化性,能够将碘离子氧化成碘单质;
D.酸性条件下Na2FeO4与稀硫酸发生反应生成硫酸铁、硫酸钠、氧气和水.
解答 解:A.铝溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故A错误;
B.向FeBr2溶液中通入过量的Cl2,亚铁离子和溴离子完全反应,正确的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B错误;
C.氢氧化铁与HI发生氧化还原反应,正确的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故C错误;
D.向Na2FeO4溶液中加入稀硫酸产生氧气,反应的化学方程式为:4FeO42-+20H+═4Fe3++3O2↑+10H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
6.重结晶的主要成分是BaSO4,用重晶石制备Ba(OH)2•8H2O的主要过程如图所示.下列分析错误的是( )
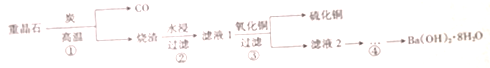

| A. | 步骤①中BaSO4作氧化剂 | |
| B. | 步骤②所得滤液1呈中性 | |
| C. | 步骤③中发生复分解反应 | |
| D. | 步骤④的实验操作中不需要用到石棉网、坩埚 |
7.向FeI2和FeBr2物质的量之比为2:3的混合溶液中逐滴滴入氯水,下列离子反应可能发生的是( )
| A. | 10Fe2++8I-+4Br-+11Cl2→10Fe3++4I2+2Br2+22Cl- | |
| B. | 2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- | |
| C. | 6Fe2++4I-+5Cl2→6Fe3++2I2+10Cl- | |
| D. | 6Fe2++2I-+6Br-+7Cl2→6Fe3++I2+3Br2+14Cl- |
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol对苯二甲酸中含有双键的数目为0.2NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | Fe在少量Cl2中燃烧生成0.5 mol产物,转移的电子数为NA | |
| D. | 标准状况下,2.24L H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
11.下列说法正确的是( )
| A. | SO2能使溴水褪色,这表现了SO2的漂白性 | |
| B. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| C. | 氨的水溶液能导电,所以氨是强电解质 | |
| D. | 按a、b两种途径制备等量的硝酸镁,消耗的二种酸的物质的量不同 途径a:Mg$→_{△}^{O_{2}}$MgO$\stackrel{稀硝酸}{→}$Mg(NO3)2 途径b:Mg$\stackrel{浓硫酸}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
8.锌银电池在放电时,电池总反应方程式可表示为:Zn+Ag2O+H2O=Zn(OH)2+2Ag.下列有关化学电池的说法正确的是( )
| A. | 该电池又称纽扣电池,是可充电池,适用于大电流连续放电 | |
| B. | 该电池属于碱性电池,放电过程中,锌失去电子生成锌离子,向负极移动 | |
| C. | 该电池在放电过程中,正极的pH变大 | |
| D. | 该电池的负极反应式:Zn-2e-=Zn2+ |
5.下列说法正确的是( )
| A. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 | |
| B. | 两种元素组成的分子中一定只有极性键 | |
| C. | 只含共价键的物质,一定是共价化合物 | |
| D. | 氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
6.在明矾溶液中逐滴加入Ba(OH)2溶液,不可能发生的反应的离子方程式是( )
| A. | Al3++SO42-+Ba2++3OH-→BaSO4↓+Al(OH)3↓ | |
| B. | Al3++2SO42-+2Ba2++4OH-→BaSO4↓+AlO2- | |
| C. | 2 Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ | |
| D. | 4Al3++7SO42-+7Ba2++14OH-→7BaSO4↓+2Al(OH)3↓+2AlO2- |