题目内容
14.将32.64g Cu与140mL一定浓度的HNO3反应,Cu完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.(1)NO的体积为多少?
(2)求消耗的硝酸物质的量.
分析 (1)设NO和NO2的物质的量分别为xmol、ymol,根据二者总体积、电子转移守恒列方程,再根据V=nVm体积.
(2)根据N原子守恒计算消耗的硝酸.
解答 解:(1)32.64g铜的物质的量为$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol
令NO和NO2的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=1.02}\end{array}\right.$
解得x=0.26,y=0.24,
V(NO)=0.26mol×22.4L/mol=5.824L;
答:NO的体积为5.824L;
(2)由N原子守恒可知,反应消耗的硝酸为n(HNO3)=2n(Cu(NO3)2)+n(NOx)=0.51mol×2+0.5mol=1.52mol;
答:消耗的硝酸物质的量为1.52mol.
点评 本题考查化学方程式计算,难度不大,注意利用电子转移守恒和原子守恒进行解答,避免利用方程式计算的繁琐,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
4.下列叙述正确的是( )
| A. | Al(OH)3是医用的胃酸中和剂的一种 | |
| B. | 铁的氧化物都不溶于水,但可与水反应 | |
| C. | 铁容易形成致密的氧化膜,抗腐蚀性能好 | |
| D. | 取一片铝条放在酒精灯上加热至熔化,铝会滴落下来 |
5.如图是MgSO4、NaCl的溶解度曲线.下列说法正确的是( )


| A. | MgSO4的溶解度随温度升高而升高 | |
| B. | NaCl的溶解度比MgSO4的溶解度大 | |
| C. | 在t2℃时,MgSO4饱和溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
2.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是( )
| A. | BaCl2溶液 | B. | K2SO4溶液 | C. | FeCl3溶液 | D. | NaCl溶液 |
19.下列实验过程中,未涉及氧化还原反应的是( )
| A. | 粗盐提纯 | B. | 海带提碘 | C. | 氯气溶于水 | D. | 电解水 |
6.重结晶的主要成分是BaSO4,用重晶石制备Ba(OH)2•8H2O的主要过程如图所示.下列分析错误的是( )
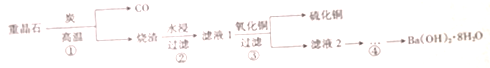

| A. | 步骤①中BaSO4作氧化剂 | |
| B. | 步骤②所得滤液1呈中性 | |
| C. | 步骤③中发生复分解反应 | |
| D. | 步骤④的实验操作中不需要用到石棉网、坩埚 |
3.短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数的差为8,A原子最外层电子数是其次外层电子数的3倍,B原子在同周期主族元素中的原子半径最大.下列说法正确的是( )
| A. | 原子半径:r(C)<r(D)<r(B) | |
| B. | 元素A与B只能形成一种化合物 | |
| C. | A的简单气态氢化物的热稳定性比C的强 | |
| D. | C的最高价氧化物的水化物的酸性比D的强 |
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol对苯二甲酸中含有双键的数目为0.2NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | Fe在少量Cl2中燃烧生成0.5 mol产物,转移的电子数为NA | |
| D. | 标准状况下,2.24L H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
 .
.