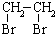题目内容
7.可逆反应A(g)+3B(g)?2C(g);△H=-Q kJ/mol.有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=4Q2.下列叙述不正确的是( )| A. | 乙中C的转化率为20% | |
| B. | Q1+Q2=Q | |
| C. | 达到平衡后,再向乙中加入0.25 molA、0.75molB、1.5molC,平衡向正反应方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g);△H=+Q2kJ•mol-1 |
分析 由Q1=3Q2,可知△n甲(A)=3△n乙(A),设甲中达到平衡时转化了xmolA,则△n乙(A)=$\frac{x}{3}$mol,
甲 A(g)+3B(g)?2C(g)
起始(mol):1 3 0
转化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
乙 A(g)+3B(g)?2C(g)
起始(mol):0 0 2
转化(mol):$\frac{x}{3}$ x $\frac{2}{3}$x
平衡(mol):$\frac{x}{3}$ x 2-$\frac{2}{3}$x
利用“一边倒法”,可知“1 mol A、3 mol B”与“2 mol C”是等效物料,它们在同温同容的条件下建立的平衡状态完全相同,则1-x=$\frac{x}{3}$,x=0.75,
α(A)=$\frac{0.75mol}{1mol}$×100%=75%,据此回答.
解答 解:由Q1=3Q2,可知△n甲(A)=3△n乙(A),设甲中达到平衡时转化了xmolA,则△n乙(A)=$\frac{x}{3}$mol,
甲 A(g)+3B(g)?2C(g)
起始(mol):1 3 0
转化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
乙 A(g)+3B(g)?2C(g)
起始(mol):0 0 2
转化(mol):$\frac{x}{3}$ x $\frac{2}{3}$x
平衡(mol):$\frac{x}{3}$ x 2-$\frac{2}{3}$x
利用“一边倒法”,可知“1 mol A、3 mol B”与“2 mol C”是等效物料,它们在同温同容的条件下建立的平衡状态完全相同,则1-x=$\frac{x}{3}$,x=0.75,α(A)=$\frac{0.75mol}{1mol}$×100%=75%,
A、甲容器中开始加入1molA的和3molB与乙容器中开始加入2mol C为完全等效平衡,平衡时相同组分的物质的量相等,故乙中C的转化率和甲中A的转化率相等,为75%,故A正确;
B、若向相同容积的另一密闭容器中通入2molC,相当于1molA和3molB,达到平衡状态,从等效平衡的角度分析,则有Q=Q1+Q3,故B正确;
C、利用“一边倒法”,可知再加入“0.25 mol A、0.75 mol B、1.5 mol C”与再加入“2 mol C”等效,在恒温恒容条件下相当于增大压强,平衡向生成C的方向移动,故C正确;
D、乙中反应掉的C为$\frac{2}{3}$xmol=$\frac{2×0.75mol}{3}$=0.5mol,所给热化学方程式中2mol C对应的反应热应为:+4Q2 kJ•mol-1,故D错误;
故选D.
点评 本题考查了化学平衡的计算,题目难度较大,注意等效平衡的应用,解答该题时利用三段式法较为直观,试题综合性强,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力.

 阅读快车系列答案
阅读快车系列答案| 选项 | 条件 | 离子组 | 共存所发生的离子反应方程式 |
| A | pH=1的溶液 | Fe2+、Al3+、Cl-、MnO4- | 10Cl-+2MnO4-+16H+═2Mn2++5Cl2↑+8H2O |
| B | 能与铝反应生成氢气的溶液 | K+、NO3-、Cl-、NH4+ | NH4++OH-═NH3•H2O |
| C | 常温下c(H+)/c(OH)-=10-10的溶液 | Na+、Cl-、S2-、SO32- | SO32-+2S2-+6H+═3S↓+3H2O |
| D | 含有大量H+的透明溶液 | Na+、Cu2+、AlO2-、SiO32- | 2H++SiO32-═H2SiO3↓ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乳酸:CH3-CHOH-COOH | |
| B. | 甘油:CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖:CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖:CH2OH-CHOH-CHOH-CHOH-CHO |
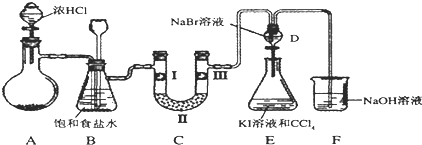
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2O.
| A. | 和铜反应 | B. | 和锌反应放出H2 | ||
| C. | 与NaCl反应制HCl | D. | 与Ca3(PO4)2反应制H3PO4 |
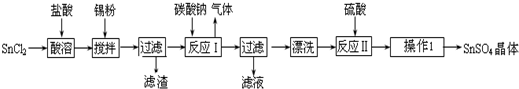

 .
.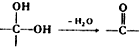
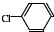 中氯原子较难水解物质A(
中氯原子较难水解物质A( 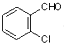 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式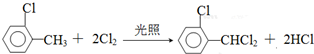 、
、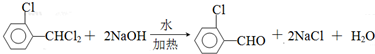 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式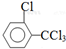 、
、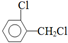 .
.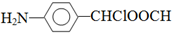 .
.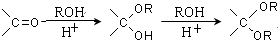
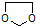 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: