题目内容
1.下列卤代烃不能够由烃经加成反应制得的是( )| A. |  | B. |  | C. |  | D. |  |
分析 卤代烃不能够由烃经加成反应制得,说明卤代烃不能发生消去反应,卤代烃发生消去反应结构特点:与-X相连碳相邻碳上有氢原子才能发生反应,形成不饱和键.
解答 解:A. 中与氯原子相连碳相邻碳上有氢原子,能发生消去反应,故A正确;
中与氯原子相连碳相邻碳上有氢原子,能发生消去反应,故A正确;
B. 中与氯原子相连碳相邻碳上有氢原子,能发生消去反应,故B正确;
中与氯原子相连碳相邻碳上有氢原子,能发生消去反应,故B正确;
C. 与-X相连碳相邻碳上没有氢原子,不能发生消去反应,故C错误;
与-X相连碳相邻碳上没有氢原子,不能发生消去反应,故C错误;
D. 中与氯原子相连碳相邻碳上有氢原子,能发生消去反应,故D正确.
中与氯原子相连碳相邻碳上有氢原子,能发生消去反应,故D正确.
故选C.
点评 本题考查卤代烃能发生消去反应结构特点,难度不大,注意卤代烃能发生消去反应结构特点:与-X相连碳原子邻位碳原子上必须有氢原子.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
16.由N2O和NO反应生成N2和NO2的能量变化如图所示.下列说法错误的是( )
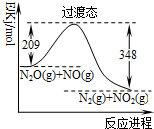

| A. | 使用催化剂可以降低过渡态的能量 | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)→N2(g)+NO2(g)+139kJ | |
| D. | 反应物的键能总和大于生成物的键能总和 |
13.25℃、101kPa下:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s) 放出414kJ的热量
②2Na(s)+O2(g)=Na2O2(s) 放出511kJ的热量
下列说法正确的是( )
②2Na(s)+O2(g)=Na2O2(s) 放出511kJ的热量
下列说法正确的是( )
| A. | ①和②产物含有阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率越来越快 | |
| D. | 25℃.101kPa下:Na2O2(s)+2Na(s)═2Na2O(S) 放出317kJ的热量 |
11.新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
②LiBH4由Li+和BH4-构成,BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3.
③Li、B、H元素的电负性由小到大小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
M是Mg(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为142pm,NaH的理论密度是1.37g•cm-3.[Na-23].
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
②LiBH4由Li+和BH4-构成,BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3.
③Li、B、H元素的电负性由小到大小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为142pm,NaH的理论密度是1.37g•cm-3.[Na-23].

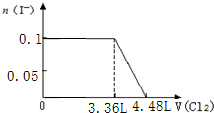
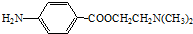 )可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):
)可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):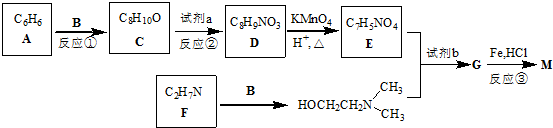
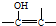 的结构不稳定.
的结构不稳定.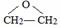 FH3C-NH-CH3
FH3C-NH-CH3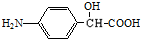 .
.