题目内容
9.某溶液中有S2-、SO32-、Br-、I-四种阴离子各0.1mol.现通入Cl2,则通入Cl2的体积(标准状况)和溶液中相关离子的物质的量的关系图正确的是( )| A. | 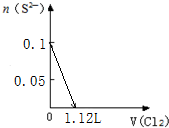 | B. | 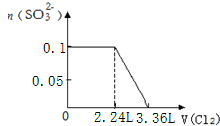 | ||
| C. | 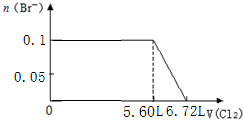 | D. | 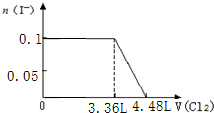 |
分析 离子还原性S2->SO32->I->Br-,故首先发生反应S2-+Cl2=S↓+2Cl-,然后发生反应SO32-+Cl2+H2O=SO42-+2Cl-+2H+,再发生反应2I-+Cl2=I2+2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,据此判断.
解答 解:离子还原性S2->SO32->I->Br-,故首先发生反应S2-+Cl2=S↓+2Cl-,然后发生反应SO32-+Cl2+H2O=SO42-+2Cl-+2H+,再发生反应2I-+Cl2=I2+2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,
A.由S2-+Cl2=S↓+2Cl-可知,0.1molSO32-完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为0.1mol×22.4L/mol=2.24L,图象中氯气的体积不符合,故A错误;
B.0.1molS2-完全反应后,才发生SO32-+Cl2+H2O=SO42-+2Cl-+2H+,0.1molS2-完全反应需要消耗0.1mol氯气,故开始反应时氯气的体积为2.24L,0.1molSO32-完全反应消耗0.1氯气,故0.1molSO32-完全反应时氯气的体积为0.2mol×22.4L/mol=4.48L,图象中氯气的体积不符合,故B错误;
C.0.1molS2-完全反应需要消耗0.1mol氯气,0.1molSO32-完全反应消耗0.1氯气,0.1molI-完全反应消耗0.05氯气,故溴离子开始反应时氯气的体积为0.25mol×22.4L/mol=5.6L,由2Br-+Cl2=Br2+2Cl-可知,0.1molBr-完全反应消耗0.05氯气,故Br-完全时消耗的氯气体积为0.3mol×22.4L/mol=6.72L,图象与实际符合,故C正确;
D.0.1molS2-完全反应需要消耗0.1mol氯气,0.1molSO32-完全反应消耗0.1氯气,0.1molI-完全反应消耗0.05氯气,故I-完全时消耗的氯气体积为0.25mol×22.4L/mol=5.6L,图象中氯气的体积不符合,故D错误;
故选C.
点评 本题以图象形式考查氧化还原反应、有关离子反应计算等,难度中等,确定离子反应发生的先后顺序是解题的关键.

| A. | Al比Cu活泼,Al为负极,Cu极上析出NO2 | |
| B. | Cu比Al活泼,Cu为负极,Al极上析出Cu | |
| C. | Cu为负极,电极反应:Cu-2e-═Cu2+ | |
| D. | Al为正极,电极反应:2H++2e-═H2↑ |
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H<0,△S>0 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ/mol | |
| C. | 铜分别与浓HNO3、稀HNO3反应,还原产物分别为NO2、NO,所以浓HNO3氧化性小于稀HNO3 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
(1)已知某盐在不同温度下的溶解度(见下表)
| T/℃ | 0 | 10 | 20 | 30 | 40 |
| S(g/100g水) | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
A.0℃~10℃B.10℃~20℃C.20℃~30℃D.30℃~40℃
(2)t℃时,CuSO4在水中溶解度为25g,将32g CuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4•5H2O晶体析出,则m的取值范围是18<m<128.
(3)向50mL 4mol/L的NaOH溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.97g.请通过计算确定该无水物的成分.
(4)下面是四种盐在不同温度下的溶解度(克/100克水)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
取23.4g NaCl和40.4g KNO3,加70.0g H2O,加热溶解.在100℃时蒸发掉50.0g H2O,维持该温度,过滤出晶体,计算所得晶体质量m1的值.将滤液冷却至10℃,待充分结晶后,过滤,计算所得晶体的质量m2的值.
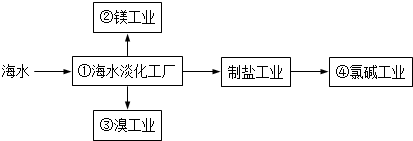
| A. | ①中可采用蒸馏法 | B. | ②中可通过电解法制金属镁 | ||
| C. | ③中提溴涉及到复分解反应 | D. | ④的产品可生产盐酸、漂白液等 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| B. | 煤的气化和液化能提高煤的利用率、减少污染 | |
| C. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| D. | 煤的干馏、石油的分馏为物理变化 |
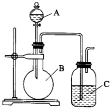 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.