题目内容
11.A、B、C、D、E为五种短周期元素,其原子序数依次增大.A元素的最高正价与最低负价的代数和等于2,B、D分别是地壳含量最多的非金属和金属元素,B2-与C+离子的电子层结构相同,E在同周期元素中原子半径最小.回答下列问题:(1)写出下列元素符号:A:N;E:Cl.
(2)B元素在周期表中的位置是第二周期第VIA族,其非金属性比A的非金属性强(填“强”或“弱”).
(3)A、B、E原子半径由大到小的顺序为Cl>N>O(用元素符号表示),由B、C元素组成的原子个数比为 1:1的化合物为Na2O2.
(4)E单质通入C的最高价氧化物对应水化物的溶液中,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
分析 A、B、C、D、E为五种短周期元素,其原子序数依次增大.B、D分别是地壳含量最多的非金属和金属元素,则B为氧元素、D为Al;A元素的最高正价与最低负价的代数和等于2,处于ⅤA族,原子序数小于氧,故A为氮元素;B2-与C+离子的电子层结构相同,则C为Na;E原子序数大于Na,处于第三周期,在同周期元素中原子半径最小,则E为Cl,以此解答该题.
解答 解:A、B、C、D、E为五种短周期元素,其原子序数依次增大.B、D分别是地壳含量最多的非金属和金属元素,则B为氧元素、D为Al;A元素的最高正价与最低负价的代数和等于2,处于ⅤA族,原子序数小于氧,故A为氮元素;B2-与C+离子的电子层结构相同,则C为Na;E原子序数大于Na,处于第三周期,在同周期元素中原子半径最小,则E为Cl,
(1)由以上分析可知A为N,E为Cl,故答案为:N;Cl;
(2)B为氧元素,位于周期表第二周期 第VIA族,同周期元素从左到右非金属性逐渐增强,则Cl的非金属性较强,故答案为:第二周期 第VIA族; 强;
(3)原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径逐渐减小,则Cl>N>O,由B、C元素组成的原子个数比为 1:1的化合物为Na2O2,
故答案为:Cl>N>O;Na2O2;
(4)氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 O本题考查结构性质位置关系应用,题目难度中等,推断元素是解题关键,注意对基础知识的理解掌握,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
14.向一定量的Fe、FeO、Fe2O3的混合物中,加入50mL l moL/L的盐酸;恰好使混合物完全溶解并放出标准状况下112mL气体.向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为( )
| A. | 11.2g | B. | 5.6g | C. | 2.8g | D. | 1.4g |
15.在一定条件下,反应2A(g)+B(g)?2C(g)在一密闭容器中达到平衡.充入适量B气体并维持B浓度和容器的温度不变,增大容器的体积,跟原平衡相比较达到新平衡时A的转化率将( )
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
12.将铝片和铜片用导线连接后,插人盛浓硝酸的烧杯中,下列叙述正确的是( )
| A. | Al比Cu活泼,Al为负极,Cu极上析出NO2 | |
| B. | Cu比Al活泼,Cu为负极,Al极上析出Cu | |
| C. | Cu为负极,电极反应:Cu-2e-═Cu2+ | |
| D. | Al为正极,电极反应:2H++2e-═H2↑ |
6.25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
| A. | 12.5% | B. | 25% | C. | 50% | D. | 75% |
3.已知自然界的氧原子有3种:16O、17O、18O,氢原子有1H、2H,从水分子的原子构成来看,自然界的水共有( )
| A. | 2种 | B. | 6种 | C. | 9种 | D. | 12种 |
20.下列说法正确的是( )
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H<0,△S>0 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ/mol | |
| C. | 铜分别与浓HNO3、稀HNO3反应,还原产物分别为NO2、NO,所以浓HNO3氧化性小于稀HNO3 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
1.下列卤代烃不能够由烃经加成反应制得的是( )
| A. |  | B. |  | C. |  | D. |  |
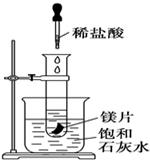 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题: