题目内容
10.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为( )| A. | N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2MH3(g)△H=-38.6kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H=38.6kJ•mol-1 | |
| D. | 不能确定 |
分析 该反应为可逆反应,0.5mol氮气和,1.5mol氢气完全反应生成的氨气小于1mol,即生成1mol氨气放出的热量大于19.3kJ,由此分析解答.
解答 解:该反应为可逆反应,0.5mol氮气和,1.5mol氢气完全反应生成的氨气小于1mol,即生成1mol氨气放出的热量大于19.3kJ,所以不知具体的反应热,所以无法写具体的热化学方程式,故选D.
点评 本题考查热化学方程式的书写,学生要注意可逆反应中反应物不可能完全转化成生成物,比较容易.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.锰丝放入稀硫酸中,有气泡产生,放入硫酸铝溶液中,表面没有金属析出.下列关于锰活动性判断不正确的是( )
| A. | Mn>Cu | B. | Al>Mn | C. | Mn>Mg | D. | Mn>H |
1.室温下,将0.20mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
| 加入的物质 | 结论 | |
| A | 100mL 2mol•L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.20molCaO | 溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 |
| C | 200mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 0.4molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
15.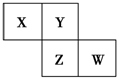 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 四种元素的简单氢化物都为极性分子 | |
| B. | 最高价氧化物对应的水化物的酸性W比Z弱 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
2.下列说法正确的是( )
| A. | 气体的摩尔体积约为22.4L•mol-1 | |
| B. | 在标准状况下,1mol任何物质所占的体积都约为22.4L | |
| C. | HNO3的摩尔质量是63g | |
| D. | 硫酸和磷酸的摩尔质量相等,都是98g/mol |
19.某透明溶液中加铝放出氢气,则在该溶液中一定能大量共存的离子组是( )
| A. | K+、Br-、Cl-、SO42- | B. | SCN-、Fe3+、Cl-、K+ | ||
| C. | K+、Cu2+、SO42-、Na+ | D. | Na+、ClO-、NO3-、SO42- |
20.下列说法正确的是( )
| A. | 铁是一种非常活泼的金属 | B. | 镁可以与氧气反应生成氧化镁 | ||
| C. | 钠的硬度大 | D. | 铝的常见氧化物是Al3O4 |

