题目内容
19.某透明溶液中加铝放出氢气,则在该溶液中一定能大量共存的离子组是( )| A. | K+、Br-、Cl-、SO42- | B. | SCN-、Fe3+、Cl-、K+ | ||
| C. | K+、Cu2+、SO42-、Na+ | D. | Na+、ClO-、NO3-、SO42- |
分析 溶液能与铝反应,且放出的气体为氢气,则溶液为非氧化性酸或强碱溶液,再结合离子之间不能结合生成水、气体、沉淀、弱电解质等,不能发生氧化还原反应等,则离子能大量共存,以此来解答.
解答 解:溶液能与铝反应,且放出的气体为氢气,则溶液为非氧化性酸或强碱溶液,
A.酸、碱溶液中该组离子之间均不反应,能大量共存,故A正确;
B.SCN-、Fe3+发生络合反应,不能大量共存,故B错误;
C.碱性条件下Cu2+生成氢氧化铜沉淀,不能大量共存,故C错误;
D.酸性条件下ClO-不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存,为高频考点,把握题目中的信息及常见离子之间的反应即可解答,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
10.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为( )
| A. | N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2MH3(g)△H=-38.6kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H=38.6kJ•mol-1 | |
| D. | 不能确定 |
7.炽热的炉膛内有反应:C(s)+O2(g)═CO2(g)△H=-392KJ/mol,往炉膛内通入水蒸气时,有如下反应:C(s)+H2O(g)═H2(g)+CO(g)△H=+131KJ/mol,CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282KJ/mol,H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241KJ/mol,由以上反应推断往炽热的炉膛内通入水蒸气时( )
| A. | 既不能使炉火瞬间更旺,又不能节省燃料 | |
| B. | 虽不能使炉火瞬间更旺,但可以节省燃料 | |
| C. | 既能使炉火瞬间更旺又可以节省燃料 | |
| D. | 不能节省燃料,但能使炉火瞬间更旺 |
16.离子是构成物质的基本微粒之一,下表中是中学常见的离子:
回答下列问题:
(1)Cl-离子的结构示意图是 . Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.
. Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.
(2)将含OH-离子的溶液 滴入浓度均为0.1 mol/L的Al3+和NH4+的混合溶液中,若测得溶液中NH4+减少了一半,此时,溶液中不存在(填“存在”或“不存在”)大量的Al3+.
(3)物质A和B分别由上表中的两种离子组成,将它们分别溶于水中,A的溶液显酸性,将A、B两溶液混合,微热,既有白色沉淀,又有使湿润的红色石蕊试纸变蓝的气体生成.
则B的阳离子是Ba2+,用离子方程式表示A溶液显酸性的原因NH4++H2O NH3•H2O+H+.
NH3•H2O+H+.
(4)常温下,将(NH4)2CO3溶于水,得到含有大量NH4+和CO32-的溶液,往溶液中滴入少量氨水,测得溶液中N H4+和CO32 -的浓度比为2:1,此时该溶液的pH<( 填“<”、“=”或“>”)7.
(5)在微生物作用的条件下,NH4+可被空气氧化成NO3-.写出该反应的离子方程式:NH4++2O2=NO3-+H2O+2H+.
(6)在一个固定容积为5L的密闭容器中充入0.10mol N2和0.30molH2,一定条件下,半分钟后达到平衡,测得容器中含NH3 0.08mol,则ν(H2)=0.048mol.L-1.min-1,此时N2的转化率为40%;若继续通入0.10mol N2和0.30molH2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”).
| 阳离子 | K+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、SO42-、CO32- |
(1)Cl-离子的结构示意图是
 . Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.
. Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.(2)将含OH-离子的溶液 滴入浓度均为0.1 mol/L的Al3+和NH4+的混合溶液中,若测得溶液中NH4+减少了一半,此时,溶液中不存在(填“存在”或“不存在”)大量的Al3+.
(3)物质A和B分别由上表中的两种离子组成,将它们分别溶于水中,A的溶液显酸性,将A、B两溶液混合,微热,既有白色沉淀,又有使湿润的红色石蕊试纸变蓝的气体生成.
则B的阳离子是Ba2+,用离子方程式表示A溶液显酸性的原因NH4++H2O
 NH3•H2O+H+.
NH3•H2O+H+.(4)常温下,将(NH4)2CO3溶于水,得到含有大量NH4+和CO32-的溶液,往溶液中滴入少量氨水,测得溶液中N H4+和CO32 -的浓度比为2:1,此时该溶液的pH<( 填“<”、“=”或“>”)7.
(5)在微生物作用的条件下,NH4+可被空气氧化成NO3-.写出该反应的离子方程式:NH4++2O2=NO3-+H2O+2H+.
(6)在一个固定容积为5L的密闭容器中充入0.10mol N2和0.30molH2,一定条件下,半分钟后达到平衡,测得容器中含NH3 0.08mol,则ν(H2)=0.048mol.L-1.min-1,此时N2的转化率为40%;若继续通入0.10mol N2和0.30molH2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”).

 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
 或
或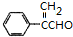 .
.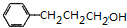 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$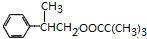 +H2O或(CH3)3CCOOH+
+H2O或(CH3)3CCOOH+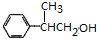 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$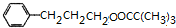 +H2O.
+H2O. .
.